Tekintse meg az e médiumban megjelent cikkeket és tartalmakat, valamint a tudományos folyóiratok e-összefoglalóit a megjelenés idején
Figyelmeztetéseknek és híreknek köszönhetően mindig tájékozott maradjon
Hozzáférhet exkluzív promóciókhoz az előfizetéseken, az indításokon és az akkreditált tanfolyamokon
A Colombian Journal of Cancerology a National Cancer Institute (INC) hivatalos kiadványa. Időszakosan negyedéves, célja ennek az orvosi szakterületnek az ismereteinek bővítése és terjesztése. A Journal cikkeket közöl: a karcinogenezis molekuláris mechanizmusai és a kezelésre adott válasz; rák epidemiológia; a daganatos betegségek klinikai jellemzői és kezelése, valamint a rák elleni küzdelem közegészségügyi intézkedései.
Indexelve:
Scielo, DOAJ, Publindex, Imbiomed, orgonák, Latindex, Embase és ScienceDirect
Kövess minket:
A CiteScore a közzétett cikkenként kapott idézetek átlagos számát méri. Olvass tovább
Az SJR egy tekintélyes mutató, amely azon az elképzelésen alapul, hogy az összes idézet nem egyenlő. Az SJR a Google oldalrangjához hasonló algoritmust használ; a publikáció hatásának mennyiségi és minőségi mértéke.
A SNIP lehetővé teszi a különböző tantárgyakból származó folyóiratok hatásának összehasonlítását, korrigálva az idézés valószínűségében a különböző tantárgyak folyóiratai között fennálló különbségeket.
- Összegzés
- Kulcsszavak
- Absztrakt
- Kulcsszavak
- Bevezetés
- Összegzés
- Kulcsszavak
- Absztrakt
- Kulcsszavak
- Bevezetés
- A rák kezelésében használt növényi vegyületek
- Hatásmechanizmusok és kemorezisztencia
- Apoptózis és apoptózist gátló fehérjék
- Összeférhetetlenség
- Bibliográfia
A természetes termékek jelentették a legreprezentatívabb forrást a rák kezelésére szolgáló terápiás szerek előállításában, és óriási hozzájárulásukat új, változatos hatásmechanizmusú citotoxikus molekulák felfedezésében ismerik el. A rák kezelésére használt gyógyszerek többsége nem túl szelektív, magas rezisztencia- és toxicitási szinttel rendelkezik, ami jelentősen befolyásolja az ebben a betegségben szenvedő betegek életprognozését. Ez a cikk áttekinti a rák kezelésére növényi forrásokból nyert aktív alapelveket és azok különböző hatásmechanizmusait, kitérve a terápiás célpontok, például az apoptózis-gátló fehérjék (IAP) és néhány, a szerkezetileg egyszerű természetes molekulának a klinikai klinika különböző fázisaiban elért legújabb fejlődéseire vizsgálatokat, és amelyek farmakológiai szinten érdekesek a magas szelektivitásuk, az alacsony toxicitásuk és a különböző ráktípusok elleni nagy terápiás potenciáljuk miatt.
A természetes termékek jelentették a legreprezentatívabb kismolekulák forrását a rákterápiában, és hatalmas mértékben hozzájárultak új, változatos hatásmechanizmusú gyógyszerek felfedezéséhez. Ezen gyógyszerek többsége erősen mérgező és alacsony specifitással rendelkezik a rákos sejtekkel szemben, ami jelentősen befolyásolja a betegségben szenvedő betegek túlélési prognózisát. Jelen cikk célja a bioaktív fitokemikáliák rák elleni hatásmechanizmusának megvitatása. A legígéretesebb terápiás célpontokat mutatják be, mint például az apoptózis fehérjék inhibitorát (IAP), valamint néhány farmakológiai szempontból érdekes és a rákos sejtekkel szemben magas specificitású bioaktív kis molekulát.
Annak ellenére, hogy az elmúlt években a tudósok újrakezdték a természetes termékek kutatását, mint olyan új gyógyszerek forrását, amelyek olyan krónikus betegségek kezelésére szolgálnak, mint az Alzheimer-kór, az ízületi gyulladás, a hepatitis, a cukorbetegség, a tuberkulózis, az AIDS és a rák; ma sok fejlődő ország továbbra is használja a hagyományos orvoslást az alacsony költségek és a gyógyszeres kezelések korlátozott hozzáférése miatt. Ez az etnobotanikai ismeretek számos esetben felelősek a különböző betegségek elleni új hatóanyagok felfedezéséért, például a vinblasztin, a taxol, az etopozid és az irinotekán természetes vegyületek új megvilágítást hoztak a rákos betegek kezelésében 1 . Azonban ezekre a molekulákra jellemző kémiai és strukturális komplexitás megnehezíti és izolálja az új szintetikus utak izolálását, strukturális tisztázását és előállítását nagyobb mennyiségben.
A rák kezelésében használt növényi vegyületek
A természetes termékek jelentősége az új gyógyszerek kifejlesztésében abban rejlik, hogy az 1981 és 2002 között a rák és egyes fertőző betegségek kezelésére használt gyógyszerek 75% -a természetes termékekből származott; később és 2002 és 2005 között pedig a természetes forrásoknak köszönhetően 23 új gyógyszert vezettek be a piacra különböző betegségek kezelésére 12. 2007-ben és 2008-ban 55 új, természetes termékekből származó gyógyszer került forgalomba, amelyek közül 16 természetes forrásból, 39 pedig ezekből nyert kémiai szerkezetekből származott. Valójában, ha az 1940 és 2010 között a rák kezelésére jóváhagyott 206 gyógyszer közül a nagy molekulatömegű hatóanyagokat tartalmazó gyógyszereket kizárják, akkor 175 gyógyszer maradna, amelyek közül 131 (kb. 75%) természetes termékekkel kapcsolatos, vagy azért, mert közvetlenül természetes forrásból nyerik, vagy természetes szerkezet kémiai szintézisével nyerik, vagy kis kémiai módosításokat végeznek a természetes forrásból származó vegyületekben 14 .
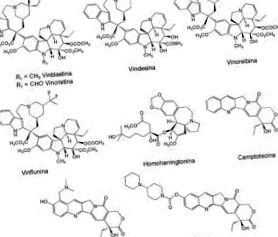
Az emlő-, here-, tüdő- és leukémiarák kezelésére leginkább használt természetes növényi vegyületek között különféle alkaloidok (1. ábra) találhatók, például vinblasztin és vinkrisztin, amelyeket a Catharanthus roseus (Apocynaceae) tizenöt endemikus növényfajából izoláltak; kamptotecin, a Camptotheca acuminata (Cornaceae) 16 fajból izolálva; és az örökzöld Cephalotaxus harringtonia-ból izolált homoharringtonin K. Koch var. Harringtonia (Cephalotaxaceae) Japánban honos. Ezekből a vegyületekből olyan félszintetikus származékokat fejlesztettek ki, amelyek javítják aktivitásukat vagy oldhatóságukat, például vindesin, vinorelbin, vinflunin, topotekán és irinotekán (1. ábra), utóbbi kettőt Hycamtin és Campostar néven forgalmazzák a GlaxoSmithKline és a Pfizer, vastagbél és petefészekrák kezelések 5,17 .
Növényi forrásokból (vinblasztin, vinkrisztin, homoarringtonin, kamptotecin) és szintetikus analógokból (vindesin, vinolerbin, vinflunin, topotekán, irinotekán) izolált rákellenes alkaloidok klinikai alkalmazásban.
A lignán típusú vegyületek (2. ábra) között vannak a Larrea tridentata (Zygophyllaceae) fajból izolált nordihidroguayaretsav és a Podophyllum (Berberidaceae) nemzetség növényfajaiból izolált podophyllotoxin, elsősorban Podophyllum peltatum és Podophyllum notatum, amelyekből a Etopozid és tenipozid származékokat kaptunk, amelyeket különböző típusú limfómák és leukémiák kezelésére használtak 12. A Combretum caffrum (Combretaceae) növényfajokból izolált stilbenekről, például kombrestatinokról (2. ábra) is beszámoltak, ahol a combstatin A 4-ből analóg kombrestatin A 4 -foszfátot nyertek, amely vízben oldódik, és amelyek kimutatták, hogy Ígéretes aktivitás a pajzsmirigyrák ellen az előzetes klinikai vizsgálatok során 18 .
Bioaktív fenolos vegyületek a rák különböző típusai ellen. Lignán típusú (nordihidroguayaretsav, podofillotoxin, etopozid, tenipozid); stilbene (combrestatin A4, combrestatin A4P) és flavonoid (kvercetin, genistein, rohitukin, flavopiridol, fenoxi-diol, P276-00).
A flavonoid típusú vegyületek (2. ábra), amelyek a legtöbb gabonában, zöldségben és gyümölcsben vannak jelen, fontos szerepet játszanak az új kevésbé mérgező gyógyszerek felfedezésében, a rák egyes típusai elleni védőhatásuk miatt; tény, amely potenciális szerekké tette őket e betegség kezelésében 11. Bár egyes flavonoidokat klinikai vizsgálatokban megelőző szerként kezdtek értékelni, az emlő-, prosztata- és húgyhólyagrák egyes típusainak kezelésére talán a legtöbbet a kvercetin, a genistein és a rohitukin 9,19. Egyes flavonoidok kémiai szerkezete kiindulópontként szolgált a flavopiridol, fenoxidiol és a P276-00 analóg (2. ábra) terápiás szerek kifejlesztésében, amelyeket klinikai vizsgálatok során a tumorok széles skálája, többek között a lymphomák ellen találtak. és leukémiák 20 .
Talán a legismertebb, természetes növényi termékekből származó kemoterápiás szerek, amelyeket a rák különböző típusainak kezelésében használnak, a 21–23-os taxánok (3. ábra), amelyeket főként a Taxus brevifolia (Taxaceae) növényfajból izolált 21–23 taxánok képviselnek (3. ábra). mint taxol. Ebből a kémiai szerkezetből indult a docetaxel és az ortataxel szintézise (3. ábra), amelyekről kimutatták, hogy aktívabbak az emlő-, petefészek- és tüdőrák ellen. Noha a preklinikai vizsgálatokban 24, 25 23 különböző taxánt találtak, és a rák kezelésében kifejtett aktivitásuk nagy segítséget nyújtott, az Anonáceae családban acetogenin típusú vegyületekről, például bullatacinról számoltak be (3. ábra), amelyek kimutatták, hogy 300-szor aktívabb, mint a taxol, ha egereknek adtuk be, amelyek L-1210 sejtekkel daganatot indukáltak (leukémia rák). A taxollal kezelt egerek súlyuk 10% -át vesztették el, míg a bullatacinnal kezeltek súlyukat 5% -kal növelték, ami arra utalhat, hogy kevésbé toxikus, mint a taxol. Jelenleg több mint 150 típusú acetogenint vizsgálnak különböző rákos sejtvonalakon 26, 27 .
A Taxus (paclitaxel), az Anonaceae (bullatacin) növényfajokból és szintetikus analógokból (docetaxel, ortataxel) izolált kemoterápiás szerek.
Néhány kinonmagvegyületről (4. ábra) szintén beszámoltak, például a Tabebuia avellanedae (Bignoniaceae) lapacho fáról izolált β-lapachonról, a hagyományos kínai orvoslásban széles körben alkalmazott Embelia ribes (Myrsinaceae) faj embelinjéről és a thymoquinonról 28 a Nigella sativa (Ranunculaceae) fajok, amelyek a 29 klinikai vizsgálat különböző szakaszaiban vannak a vastagbél-, petefészek-, tüdő-, prosztata- és emlőrák egyes típusainak kezelésére.
Rákellenes vegyületek a klinikai vizsgálat különböző fázisaiban, gyógynövényekből izolálva. Kinon típus (β-lapachon, thymoquinone, embelin, iriasferin A, SAN5201); amid (piperin, piperlongumin); Oxigenátok (perilil-alkohol, dilapiol, kurkumin) és szintetikus analógok (NSC295156, NSC698249).
Hatásmechanizmusok és kemorezisztencia
A növényi eredetű daganatellenes gyógyszereket többnyire antimitotikus szerek jellemzik, amelyek általában rákos sejtek pusztulását idézik elő, amikor mitózisban vannak 38. Ez a fő oka annak, hogy az egészséges sejtekre is hatással vannak, károsodást okozva a test bármely olyan osztódási folyamatában lévő sejtben, amely a legtöbb kemoterápiás kezelés során számos nem kívánt mellékhatást generál. Például a kamptotecin és kereskedelmi származékai, a topotekán és az irinotekán az I és II topoizomerázokra hatnak, amelyek az enzimek felelősek a DNS tekercseléséből eredő stresszek felszabadításáért a transzkripciós, helyreállítási és replikációs folyamat során, a DNS regenerálódását visszafordíthatatlanná téve. miután szétválasztották a feszültség megismétléséhez vagy oldásához, 39,40 .
A lignánok, például a podofillotoxin és kereskedelmi származékaik, az Etoposide és Teniposide, hatásmechanizmusukat nemcsak a topoizomeráz II-re gyakorolják, hanem a tubulinhoz is kötődnek, megakadályozva mind a mikrotubulusok képződését, mind pedig a DNS regenerációját annak replikációja után. A taxánok, a podofillotoxinhoz hasonlóan, a mikrotubulusok szintjén hatnak, de ahelyett, hogy gátolnák képződésüket a tubulin polimerizációjából, nagy kapacitással képesek stabilizálni struktúrájukat és megakadályozni a szétkapcsolódást, egyensúlyhiányt generálva a sejtben, amely végül apoptózisban végződik 41 .
Más vegyületek, mint például az embelin, a timokinon és a piperlongumin, az IAP 52 fehérjék antagonistáiként működhetnek, amelyek felelősek a kaszpázok szabályozásáért, amelyek a programozott sejthalál ezen formájának végrehajtásáért felelős fő fehérjék. Ezek a vegyületek megakadályozzák az XIAP fehérje kaszpázokhoz való kötődését, felszabadítva az apoptózis effektor kaszpázokat, mint például a 3. és 7. kaszpázokat, elindítva a programozott sejtpusztulás folyamatát a sejtben. Például az embelin önmagában vagy más gyógyszerekkel kombinálva hatékony a rákos sejteken, amelyek az XIAP fehérje túlzott expresszióját mutatják, ideértve a PC-3 sejteket (prosztatarák) 53 és a H460 sejteket (tüdőrák), ha ciszplatinnal kombinálva adják, olyan gyógyszer, amelyet széles körben alkalmaznak kemoterápiákban, amelyeknek a H460 sejtek rezisztensek 54 .
Apoptózis és apoptózist gátló fehérjék
Az apoptózis a sejthalál egy olyan formája, amelyet különféle morfológiai változások jellemeznek, ideértve a kromatin kondenzációt, a mag töredezettségét, a plazmamembránban lévő redőket, a citoszkeleton szétszerelését és a sejtek összehúzódását. A programozott sejthalál ezen formáját kaszpázok hajtják végre, amelyeken keresztül a sejt önszabályozott módon hajt végre fehérjéinek, citoszkeletonjának, organellumainak, maghártyájának és DNS-nek a belső pusztulásának folyamatát, az összes sejtanyagot kis testekbe csoportosítva, ún. apoptotikus testek, amelyeket később fagocitózis eliminál, anélkül, hogy gyulladásos folyamatot generálnának 59. Ez a programozott sejtpusztulás folyamata általános úton aktiválható két úton: egy belső és egy külső úton, amelyek közvetlenül függenek a 60 halálinger stimulusától (5. ábra).
Apoptózis aktivációs útvonalak: Belső út a mitokondriumokon keresztül, a citokróm C (Cit C) felszabadulásával, a kaszpáz 9 aktiválásával (9. Casp.), Az apoptózis képződésével és az ezt követő apoptózis indukciójával a 3. kaszpázon keresztül (Casp. 3); extrinsin útvonal a FasL vagy TNF-R1 halálozási doménnel társuló membránreceptorokon keresztül, a kaszpáz 8 aktiválása (8. Casp.), majd ezt követő apoptózis indukció a kaszpáz 3-on keresztül.
- Kábítószerek Akár 12 órás erekció a marihuána miatt, amely egy váratlan priapizmus eredete
- Kortikoszteroidok t; tüskék és másodlagos mellékvese-elégtelenség; kapcsolat; n az árnyékban
- Növényi turmix fehérje vékony borsó és barna rizs Aquisana vásárlás
- Vásároljon Biogrowth Kokoh Bio Papilla (6 hónap) 400 g természetes növényi ételt
- Vásároljon Organic Milk Thistle növényi olajat 250 ml Terpenic Naturitas olajat