Mik a szelenoproteinek?
A szelenoproteinek a fehérjék kizárólagos csoportja, amelyek felépítésükben tartalmaznak bizonyos szelenocisztein maradékokat (Sec), amelyeket a genetikai kód 21. aminosavának tekintenek. Ez a szokatlan aminosav cisztein (Cys) analóg és kén helyett szelént tartalmaz. A szelén számos organizmusban nélkülözhetetlen mikrotápanyag, és hiányát számos patofiziológiai állapothoz társítják, például szív- és érrendszeri betegségekhez, neuromuszkuláris rendellenességekhez, rákhoz vagy gyulladáshoz (Vyacheslav M et al, 2014).
A Sec és a Cys csoportok homológ pozíciót foglalnak el, azonban a Sec reaktívabb aminosav, mint a cisztein, és része a fehérje katalitikus doménjének. Az ismert funkciójú szelenoproteinekben mindig részt vesz a redox-reakciókban. Evolúciós szempontból és kémiai tulajdonságaik hasonlósága miatt a törzsvonal Sec-ről Cys-re specifikusan fejlődött, ezért lehetséges olyan szelenoproteinek homológjait találni, amelyek Sec helyett Cys-t tartalmaznak, meghatározva őket ortológnak vagy párhuzamos gének (Zhang Y és mtsai, 2006).
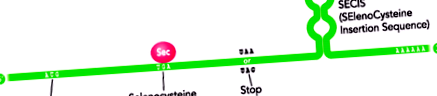
A Sec beépülését a polipeptidláncba az UGA kodon kódolása határozza meg, egy kodon, amely általában meghatározza a fehérje transzláció végét. Akkor fordul elő, amikor a szelenoproteinek mRNS-jének 3'-UTR régiójában konzervált szár-hurok struktúra van, amely SECIS elemként ismert (SElenoCysteine Insertion Sequence) (Lobanov AV és mtsai, 2009) (1.ábra).
1.ábra. Egy szelenoprotein mRNS-szerkezetének sematikus ábrázolása. Megfigyelhető az UGA kodon kettőssége, amely egyrészt a Sec aminosavat kódolja, másrészt a transzláció befejezését jelzi. A 3 'UTR régióban a SECIS elem jelenléte konzervált hurokszerkezettel tűnik ki (módosítva: Moghadaszadeh B et al, 2006).
A szelenoproteinek bioszintézise
A szelenoproteinekre jellemző, hogy a Sec aminosavat tartalmazzák. Ezt a maradékot a gén nyitott leolvasási keretében található UGA kodon (általában STOP kodon) kódolja, amelyet Sec-ként dekódolnak a riboszomális fehérjeszintézis során egy olyan mechanizmusból, amely a kanonikus transzlációs berendezés. Az UGA kodon újrakódolását irányító fő jel egy másodlagos szerkezet, amely kizárólag a szelenoprotein transzkriptumokban található, a SECIS elem. Vagyis a SECIS elem az, amely egyértelművé teszi az UGA kodon jelentését és aktiválja a Sec.
A Sec az egyetlen aminosav, amelynek szintézise a saját tRNS-jében megy végbe (nincs szabad aminosav szintézis), az úgynevezett tRNS [Ser] Sec. Ezt a tRNS-t egy szérinnel amino-acilezzük a széril-tRNS-szintetáz (SerS) által katalizált reakcióban, hogy létrejöjjön a bázisszerkezet a Sec. Bioszintéziséhez. Ezután a szerin foszforileződik foszfoszeril-tRNS-kinázzal (PSTK). A szelént viszont a szelenofoszfát-szintetáz 2 (SPS2) forforilálja, és hozzáadják a már foszforilezett szerinhez. Ezen a struktúrán a Sec szintetáz (SecS) termeli a Sec maradékot, így képezi a Sec-tRNS-t [Ser] Sec (Bellinger FP et al, 2009) (2. ábra).
2. ábra. A Sec. SerS aminoacilátok szintézisének mechanizmusa a tRNS [Ser] Sec és a SerS szerinjével, amely Ser-tRNS [Ser] Sec. Ez utóbbit a PSTK foszforilezi, amely a SecS szubsztrátumát foszforilezett szelinnel együtt biztosítja a Sec-tRNS szintéziséhez [Ser] Sec (módosítva: Labunskyy VM et al, 2014).
A Sec-tRNS [Ser] Sec beillesztése a riboszómába egy EFSec nevű specifikus megnyúlási faktorral kell, hogy felismerje. Az EFSec nem közvetlenül lép kapcsolatba a SECIS elemmel, hanem sokkal inkább a SECIS-kötő fehérjével, az SBP2 néven. Ezenkívül más tényezők, például az L30 riboszomális fehérje (amely eukarióta transzlációs iniciációs faktor, más néven eIF4a3) részt vesznek a Sec beépítésének folyamatában, válaszul az UGA kodon jelenlétére a gén olvasási keretében (Bellinger FP et al., 2009) (3. ábra).
3. ábra. A Sec beillesztésének mechanizmusa a polipeptidláncba. A SECIS elem az EFSec, SBP2 és L30 faktorok szelenoproteinek mRNS-éhez való összeszerelésének közbenső része, amely lehetővé teszi Sec beépülését az UGA kodon jelenlétére válaszul (módosítva: Labunskyy VM et al, 2014).
A Sec szintézisének és beépülésének mechanizmusának globális hasonlósága az élet három területén azt sugallja, hogy ez a jelenség az evolúcióban csak egyszer jelent meg, még mielőtt ezek a területek elváltak volna egymástól. A Sec-t nem tartalmazó vonalak megléte azt jelzi, hogy egyes esetekben ez az ősök képessége elveszett, és ez alátámasztja azt az elképzelést, hogy különböző szelektív nyomások léteznek, amelyek meghatározzák a Sec beépítésének fenntartását vagy elvesztését.
Selenoprotein családok
A szelén biológiai hatásait többnyire a szelenoproteinek közvetítik, amelyek jelen vannak az archeákban, a baktériumokban és az eukariótákban. Néhány kivételtől eltekintve a Sec aminosav az enzim aktív központjában helyezkedik el, ahol a redox-katalízis reakciókat közvetíti (Arnér ES, 2010). Emiatt a szelenoproteinek által felvett fiziológiai szerepek nagymértékben függnek a Sec jelenlététől, így az említett aminosavat befolyásoló specifikus mutációk könnyen kiválthatják inaktivációját.
A szelenoproteinek családokba sorolása a Sec aminosavláncban való elhelyezkedésétől függ (4. ábra). Egyrészt az első csoportot azok a családok alkotják, amelyeknél a Sec a fehérje C-terminális végének közelében található. Például tioredoxin-reduktázok (TrxRs) és S, I, O és K. szelenoproteinek alkotják. Másrészt a Sec N-terminális végén lévő helyzete egy második csoportot képez, amelyben a glutation-peroxidázok (GPx), jód-tironin-deodinázok (DIO-k), H, M, N, T, V és W szelenoproteinek és szelenofoszfát-szintetáz 2 (SPS2) (Lu J és Holmgren A, 2009).
Noha a szelenoproteinek eltérő biológiai szerepüket betöltő molekuláris útvonalak nagyon sokfélék és sok esetben ismeretlenek, a legtöbb rendkívül hatékony antioxidáns enzimként működik, a tioredoxin és a glutation rendszer részét képezi (Kryukov GV et al., 2003). Ezek a rendszerek fenntartják a sejtek redox homeosztázisát a NADPH redukáló erejének rovására, és egyéb fiziológiai folyamatok mellett részt vesznek a pajzsmirigyhormonok anyagcseréjében, a spermiumok érésében és az izomműködésben (Labunskyy VM et al, 2014).
4. ábra. A szelenoproteinek különböző családjainak osztályozása és funkciói. Az egyes szelenoprotein-típusok relatív hosszának diagramja a jobb oldalon látható, a Sec helyét pedig piros színnel jelölik (Labunskyy VM et al, 2014).
A szelenoproteinek fejlődése
A szelenoproteóm egy szervezet szelenoproteinek halmaza, és evolúcióját meghatározzák az organizmusok környezeti körülményei, valamint a szelén elérhetősége (Lobanov AV és mtsai, 2009). Például a vízi szervezetekre jellemző, hogy a legnagyobb szelenoproteómokkal rendelkeznek. Éppen ellenkezőleg, a szárazföldi organizmusokban a szelenoproteinek mennyisége jelentősen alacsonyabb. Az egyik legerőteljesebb hipotézis ennek a helyzetnek a magyarázatára az, hogy a szelenoproteinek antioxidáns funkciójának kulcsszerepe van a sejtek magas oxigénkoncentrációval szembeni védelmében (Jakupoglu C et al, 2005). A szárazföldi élőhelyekre való áttérés egyik következménye számos alapvető elem, például a szelén korlátozott hozzáférése, ami lényegesen kevesebb. Ennek eredményeként számos szárazföldi szervezet, például magasabb rendű növények, élesztőgombák, gombák és bizonyos állatfajok elveszítik a szelenoprotein családokat, vagy ciszteint tartalmazó homológokkal helyettesítik őket (Lobanov AV et al, 2009).
Az azonosított szelenoproteinek többsége ősi eredetű, és főleg az evolúció során keletkezett gén duplikációkból. A genomok feljegyzése, az új szelenoproteinek előrejelzésére szolgáló bioinformatikai módszerek alkalmazása és a filogenetikai rekonstrukciós modellek 45 gerinces szelenoprotein család jellemzését tették lehetővé, amelyek közül 20 egy meglévő szelenoprotein duplikációjából származik, 6 pedig a ősi szelenoproteóm (Mariotti M et al., 2012) (5. ábra). Ugyanez a tanulmány arra a következtetésre jutott, hogy az emlős szelenoproteómja viszonylag stabil maradt, és összesen 28 családból áll, és legfeljebb 25 gén kódolja a szelenoproteineket minden emlősfaj esetében. Hasonlóképpen, 21 gerincesben azonosítják a 21 szelenoproteint, míg a többiek csak bizonyos nemzetségekben találhatók meg. Ez megmutatja a szelenoproteinek lehetséges eredetét, beleértve a gén duplikációt és a ciszteinnel történő szubsztitúciót.
5. ábra. A gerinces szelenoproteóm fejlődése. Az ősszelenoproteinek piros színnel vannak feltüntetve, és evolúciós változásaikat a filogenetikai fa tükrözi. Az aláhúzott szelenoproteinek egyedülállóak a gerinces állatokra, míg a zöld szín egy új szelenoprotein képződését jelzi gén duplikációval. A törzsek során elveszett szelenoproteinek szürke színnel vannak feltüntetve, és azokat az eseteket, amikor cisztein-homológgal történt helyettesítés, kék színnel jelölték (Mariotti M et al, 2012).
Megjegyzés és jóslat
Összegzésként elmondható, hogy a szekvenált genomok elemzése, amely lehetővé teszi a szelenoproteinek jelenlétének és eloszlásának elemzését, valamint a filogenitásuk részletes tanulmányozásával, a szelenoproteinek funkciójának és implikációinak jobb megértéséhez vezet az emberi fiziológiában és patológiában.
Macaca nemestrina
A déli disznófarkú makákó (Macaca nemestrina) a Cercopithecidae családba tartozó catarrine főemlősfaj. A Maláj-félszigeten, Borneóban, Szumátrában és a Bangka-szigeten lakik. Ez egy közepes méretű, mindenevő makákó, amely főleg erdőkben él, de az emberek fejlődésével az ültetvényekben és a kertekben is megtalálható. Korábban ennek a taxonnak az alfajai ma már fajok: Macaca leonina (északi disznófarkú makákó), Macaca pagensis (a pagai makákó) és Macaca siberu (a Siberut makákó). További információkért kattintson ide.