- Tárgyak
- Összegzés
- Bevezetés
- Eredmények
- Mer eltérően jelenik meg AML-ben
- A Mer aktiválja a sejtek túlélését és az anti-apoptotikus utakat
- Mer gátlás Mer shRNS leütéssel
- A Mer gátlása shRNS alkalmazásával csökkenti a p38, ERK és CREB foszforilációját
- A Mer gátlása myeloblast apoptózist indukál in vitro
- A mer gátlás csökkenti a myeloblast proliferációt in vitro
- A Mer újbóli bevezetése megmenti a mieloblasztok azon képességét, hogy elkerüljék az apoptózist és telepeket képezzenek
- A mer gátlás növeli a leukémiamentes túlélést in vivo
- Vita
- Kiegészítő információk
- Képfájlok
- Kiegészítő ábra S1
- Word dokumentumok
- Kiegészítő S1 táblázat
- Kiegészítő táblázat S2
- Kiegészítő táblázat S3
- Kiegészítő ábrák és táblázatok
Tárgyak
- AML
- Onkogén fehérjék
- Onkogenezis
- A cikk hibajavítását 2016. szeptember 5-én tették közzé.
Összegzés
Az AML-ben végzett legújabb kutatások csak néhány rendellenesen expresszált vagy mutált fehérje-kinázt tártak fel, amelyek potenciális terápiás célként szolgálnak. Az FLT-3 belső tandem duplikációs mutáció magas allélaránya rossz prognózissal társult, és kifejlesztettek kis molekulájú inhibitorokat, amelyek az FLT-3-at expresszáló sejteket célozták meg. A 6,7 pozitív AML C-Kit, amelyet számos visszaeső páciensnél találtak, rossz prognózissal jár, és kis molekulájú inhibitorok is megcélozták. 8,9 Célzottabb terápiás lehetőségekre van szükség az AML hatékonyabb kezeléséhez vagy a nagy intenzitású kemoterápia csökkenésének lehetővé tételéhez.
Ebben a kéziratban arról számolunk be, hogy a Mer a gyermekek és felnőtt AML betegek legtöbb mintájában aberránsan túlexpresszálódik, összehasonlítva a normál mieloid progenitorokkal. A mer az AML sejtvonalak túlnyomó többségében expresszálódik. A Mer aktiválása az AML sejtvonalakban túlélési és proliferációs szignálokat eredményezett, ideértve az ERK1/2 és az AKT, valamint a p38 MAPK (p38), MSK1, CREB, ATF1 és STAT6 foszforilezését. Végül megmutatjuk, hogy a Mer gátlása az RNS-interferencia révén az emberi AML sejtvonalakban az apoptózis jelentős növekedéséhez, a kolóniák kialakulásának csökkenő képességéhez és a leukémia kialakulásának késleltetéséhez vezet immunhiányos egerekben. A terápiásan célzott aberrált Mer expresszió az AML-ben vonzó, potenciálisan jobb eredményeket tesz lehetővé magas kockázatú betegeknél, csökkentett intenzitású kombinált terápiát alacsony kockázatú betegeknél, vagy terápiás lehetőséget azok számára, akik nem tolerálják a magas kockázatú kemoterápiát.
Eredmények
Mer eltérően jelenik meg AML-ben
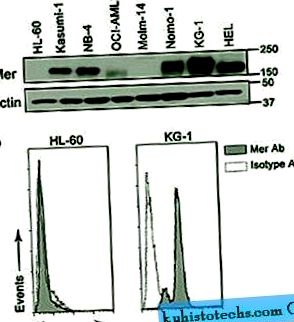
A Mer AML-ben való expressziójának értékeléséhez 14 különböző myeloid sejtvonalat értékeltünk. A Mer-t immunoblotolással detektáltuk az elemzett sejtvonalak többségében 150-180 kD fehérjeként (a méretváltozást a differenciál glikozilációnak tulajdonították 18). Az áramlási citometriás elemzés megerősítette a megállapításokat; a Mer szempontjából pozitív sejtek nagyobb fluoreszcencia intenzitást mutattak, mint az egér immunglobulin G1 izotípus kontrolljával festett sejtek, míg a negatív sejtek nem (1. ábra és az S1 kiegészítő táblázat). Elemzésünk nagyfokú korrelációt tárt fel az immunoblot és az áramlási citometriás eredmények között, és azt jelezte, hogy az AML sejtvonalak 86% -ában (14-ből 12-ben) volt bizonyos mértékű Mer-expresszió. Ebben a sejtvonal-elemzésben a Mer-expresszió nem társult semmiféle francia-amerikai-brit (FAB) vagy az Egészségügyi Világszervezet (WHO) osztályozásához, citogenetikai rendellenességéhez, annak a betegnek az életkorához, amelyből a sejtvonal származik, és nem volt összefüggésben sem Egyéb ismert klinikai jellemzők (S1 kiegészítő táblázat).
A Mer AML sejtvonalakban expresszálódik. ( nak nek ) Az AML-sejtvonalakból származó teljes sejt-lizátumokat immunblot-analízisnek vetjük alá anti-Mer antitesttel. Ez a reprezentatív blot a Mer fehérje (150-180 kD) kimutatását mutatja több AML sejtvonalban. Az aktint terhelés-kontrollként detektálták. ( b ) A sejtek felületén a mer expresszióját áramlási citometriával határoztuk meg, miután primer anti-humán Mer antitesttel és PE-konjugált szekunder antitesttel festettük (szürke hisztogram). A nem specifikus festést IgG1 izotípus kontroll primer antitest és PE-konjugált szekunder antitest (fehér hisztogram) segítségével határoztuk meg. A reprezentatív Mer negatív (HL-60) és Mer pozitív (KG-1) sejtvonalakat mutatjuk be.
Teljes méretű kép
A Mer az AML-betegekből származó legtöbb diagnosztikus csontvelőmintában expresszálódik, normál csontvelőben azonban nem. Az AML-betegek diagnózisában összegyűjtött mieloblasztokat áramlási citometriával elemeztük a Mer expressziójára. ( nak nek ) A humán CD33 és CD45 sejteket expresszáló sejteket elemeztük, miután egér anti-humán Mer antitesttel és PE konjugált másodlagos antitesttel festettük a Mer expressziót (szürke hisztogram). A nem specifikus festődést egér IgG1 izotípus kontroll antitest és PE-konjugált szekunder antitest (vak hisztogram) alkalmazásával határoztuk meg. A reprezentatív áramlási citometriás profilok Mer-pozitív (> 20% pozitív sejtek), Mer-dim (10-20% pozitív sejtek) és Mer-negatív (
Teljes méretű kép
Mer gátlás Mer shRNS leütéssel
A Mer funkcionális szerepének tanulmányozásához az AML-ben bevezettük a Mer ellen irányított rövid hajtű RNS-t (shRNS) a fent használt két sejtvonalba. A Nomo-1-et és a Kasumi-1-et két különböző shRNS konstrukció (shMer1 és shMer4) egyikét kódoló lentivírusokkal transzdukáltuk a Mer expresszió csökkentése érdekében, vagy nem csendesítő shRNS-t (shControl) fejlesztettünk ki, és stabil klónokat fejlesztettünk ki. A Mer-gátlás hatékonyságának értékelésére teljes sejt-lizátumok immunblot-analízisét végeztük. Mindkét deléciós klón hatékonyan csökkentette a Mer expressziót, az egyes sejtvonalakból származó shMer4 klónnak valamivel hatékonyabb Mer clearance-e volt, mint az shMer1 klónnak (4a. Ábra). Ezeket a megállapításokat a sejtfelszíni Mer expresszió áramlási citometriás elemzésével igazoltuk, amely mindkét konstrukciónál hatékony clearance-t mutatott, valamivel több gátlással az shMer4 sejtekben (70–80% -os csepp), mint az shMer1-ben (60% -os csökkenés), szemben az shControllal (4b. Ábra).
A Mer fehérje expresszióját csökkenti az shRNS expressziója AML sejtvonalakban. A Kasumi-1 és Nomo-1 sejteket Mer-célzó rövid hajtű RNS (shRNS) konstrukciókat (shMer1, shMer4) vagy GFP-t nem csendesítő kontrollként (shControl) tartalmazó lentivirális részecskékkel fertőztük meg. Mer eltávolítását megerősítette ( nak nek ) teljes sejt-lizátumok és ( b ) áramlási citometria anti-Mer antitest alkalmazásával. Az értékek átlagokat jelentenek, és három független kísérletből származnak. ( c ) A szülői és az shRNS-t tartalmazó Kasumi-1 és Nomo-1 sejteket szérummentes táptalajban inkubáltuk 2-3 órán át, majd egy 10 perces kezelést 200 nM rhGas6 ((+) Gas6) vagy pufferrel (elhalt szérum éhség). . A teljes sejt lizátumokat immunoblot elemzésnek vetettük alá a foszforilezett és az összes fehérjére specifikus antitestekkel, amelyeket a 3e. Ezek közül a p38, az ERK1/2 és a CREB következetesen a Mer-szintnek megfelelő foszforiláció csökkenését mutatta, amikor Gas6-tal stimulálták.
Teljes méretű kép
A Mer gátlása shRNS alkalmazásával csökkenti a p38, ERK és CREB foszforilációját
Ahhoz, hogy felmérjük, melyik utakat érintette leginkább a Mer gátlás shRNS alkalmazásával, tovább elemeztük azokat a fehérjéket, amelyek fokozott foszforilációt mutattak ki a Gas6 stimuláció után (azaz MSK1, p38, ERK, AKT, CREB, ATF1 és STAT6) Merckdown Nomo-1 és Kasumi felhasználásával. -1 sejtvonal. Amikor a szérumtól éhezett sejteket Gas6-mal stimuláltuk, a bontó sejtvonalak következetesen a p38, ERK és CREB foszforilációjának csökkenését mutatták, összehasonlítva a kizárólag pufferrel kezeltekkel (4c. Ábra).
A Mer gátlása in vitro myeloblast apoptózist indukál
A Mer gátlásának az AML-re gyakorolt fenotípusos hatásait in vitro értékelték. A Nomo-1 és Kasumi-1 sejteket shRNS konstrukciókkal vagy anélkül Yo-Pro-1 jodiddal és propidium jodiddal festettük 18 órás szérumban való éhezés után, és áramlási citometriás elemzésnek vetettük alá. Az elemzésbe beletartoztak azok a sejtek, amelyek csak Yo-Pro-1 jodidot (korai apoptózis) és azokat, amelyek Yo-Pro-1 jodidot és propidium jodidot (késői apoptózis és nekrózis) szedtek; A csak propidium-jodidot (elhalt sejteket) tartalmazó sejteket kizártuk, hogy kizárjuk az elemzés előtt elhalt sejtek elemzésének lehetőségét. A csökkent Mer-szinttel rendelkező sejtvonalak magasabb fokú apoptózist mutattak; A sejtek ∼ 35% -át (shMer1) és 55% -át (shMer4) apoptotikusnak tekintették a szérum éhezésre adott válaszként. Ez szignifikánsan nagyobb volt, mint a kontroll sejtvonalakban megfigyelt 15-20% -os apoptózis (P
A Merckdown fokozza az érzékenységet az apoptózisra. ( nak nek ) A szülői, nem csendesítő kontroll shRNS-t (shControl) és a Merckdown-ot (shMer1, shMer4) A Kasumi-1 és Nomo-1 sejteket szérumban éheztettük, vagy teljes táptalajban tenyésztettük 18 órán át, mielőtt propidium-jodiddal és I-Pro-1-jodiddal festettük volna. Az apoptotikus sejteket áramlási citometriával azonosítottuk. Reprezentatív áramlási citometriás profilokat mutatunk be. A korai apoptotikus sejtek (jobb alsó kvadráns; Yo-Pro +/PI−) és késői apoptózis/nekrózis (jobb felső kvadráns; Yo-Pro +/PI +) százalékos arányát mutatjuk be. ( b ) Az összesített adatok azt mutatják, hogy az apoptotikus sejtek jelentősen felhalmozódnak a Kasumi-1 és a Nomo-1 sejtekben, ha a Mer gátlását shRNS gátolja (* P
A Mer eltávolítása csökkenti az AML kolónia kialakulásának lehetőségét. A szülői, csendesítetlen kontroll shRNS-t (shControl) és a Merckdown (shMer1, shMer4) Nomo-1 és Kasumi-1 sejteket metilcellulózban tenyésztettük 13 napig. ( nak nek ) A Nomo-1 sejtvonal reprezentatív plakettképei láthatók. ( byd ) A telepek teljes számát a telepképződés statisztikailag szignifikáns csökkenésének kimutatásával határoztuk meg, amikor Mer (* * P
A Mer expresszió gátlása meghosszabbítja a túlélést az AML egérmodelljében. A NOD-SCID-gamma egereket 200 cGy-vel besugároztuk, és ötmillió szülői NRNA-1-vel (Parental, n = 8), irányítatlan shRNS-sel (shControl, n = 8) vagy Merckdown-nal (shMer1 n = 16, shMer4 n = 14) transzplantáltuk. ) sejtek intravénás injekcióval. A túlélést összehasonlító Kaplan-Meier-elemzés kimutatta, hogy statisztikailag szignifikáns megnyúlást mutat (P
A Mer túlzott expressziójának mechanizmusa az AML-ben nem világos; A lehetséges mechanizmusok magukban foglalják az adaptációkat transzkripciós vagy transzlációs szinten, például megváltozott promóter-metilációt vagy mikroRNS-szabályozást. Megállapították, hogy a kemoterápiás kezelés után a Tyro-3/Axl/Mer tirozin-kináz család másik tagjának, az Axl-nek a myeloid leukémiában való fokozott expressziója egybeesik az Axl-promoter fokozott metilációjával. Az emlőrák esetében a Mer szuppresszor mikroRNS elnémítása fokozott metasztázisokkal társult. 22 A leukémiában a Mer abnormális expressziója még nem társult specifikus epigenetikai elváltozásokhoz, és a Mer túlzott expressziójának mechanizmusának további értékelése AML-ben indokolt.
Ezek az eredmények arra is utalnak, hogy az AML sejtvonalak a Mer jelzésre támaszkodnak, hogy fenntartsák az életképességet stressz alatt és in vivo. Ezenkívül ezek az adatok igazolják az anti-Mer célzott terápia indoklását mind felnőtt, mind gyermek AML-ben. Potenciálisan a Mer gátlás klinikailag jelentős hatást gyakorolhat az AML életkori spektrumának mindkét végén lévő betegekre, akár monoterápiaként, akár a jelenlegi AML terápiákkal kombinálva.
Jelenleg néhány transzlációs ügynök célozza meg Meret a preklinikai fejlődésben. Ezek egyike egy nemrégiben leírt Mer monoklonális antitest, amely csökkent tumor migrációt és túlélést mutatott a glioblastoma multiforme sejtvonalakban. A korai fejlődésben vannak szelektív Mer kis molekulájú tirozin-kináz inhibitorok, amelyek hatékonyan csökkentik a Mer foszforilációját in vitro és in vivo. 33
Adataink bizonyítják azt az elképzelést, hogy a Mer terápiás célpont az AML-ben, és valószínűleg további Mer-célzott szerek, többek között további antitestek és/vagy specifikus kismolekulájú inhibitorok fejlődéséhez vezet. Ezek az új terápiák potenciálisan befolyásolhatják az AML-ben szenvedő betegeket, valamint a Mer-függőséggel jellemezhető egyéb rosszindulatú daganatos betegeket, és eszközt nyújthatnak a túlélés javítására csökkent toxicitással a jelenlegi standard kemoterápiás kezelési rendhez képest.
- Az ok, amiért az avokádó hozzájárul a fogyáshoz
- Az ok, amiért az avokádó hozzájárul a fogyáshoz Salud La Revista El Universo
- Az önellenőrzés segít fenntartani a súlyt
- DPP-4 inhibitorok egy an; GLP-1 receptor logók monoterápia sikertelensége után
- Az alváshiány megváltoztatja az anyagcserét és hozzájárul az El Diario Vasco súlygyarapodásához