Absztrakt
A zebra pinty (Taeniopygia guttata) egyre fontosabb modellszervezetté vált számos kutatási területen, ideértve az 1., 2., 3. viselkedésmódot, valamint a memóriát és a 4,5,6-os tanulást. A zebrapintz, mint egyetlen szekvenált genommal rendelkező énekesmadár, nagy lehetőségekkel rendelkezik a fejlesztési tanulmányokban; A zebra pinty korai fejlődési szakaszait azonban nem vizsgálták jól. A zebra-pinty fejlődésének hiánya a kis petesejt és embrió boncolásának nehézségének tudható be. A következő boncolási módszer minimalizálja az embrionális szövet károsodását, lehetővé téve a morfológia és a génexpresszió vizsgálatát az embrionális fejlődés minden szakaszában. Ez lehetővé teszi az embriók fénymezőbeli és fluoreszcencia minőségű képalkotását, felhasználását molekuláris eljárásokban, például in situ hibridizációban (ISH), sejtproliferációs tesztekben és RNS extrakcióban kvantitatív vizsgálatokhoz, például REA. Kvantitatív idő-PCR (qtRT-PCR) ). Ez a technika lehetővé teszi a kutatók számára a fejlődés korai szakaszainak tanulmányozását, amelyekhez korábban nehéz volt hozzájutni.
Bevezetés
Ennek a technikának az az általános célja, hogy az embriogenezis korai szakaszából származó zebra-pinty (Taeniopygia guttata) embriókat szerezzen be, hogy a fejlesztési vizsgálatok széles körében felhasználhatók legyenek. A zebrai pintyek az uralkodó modell organizmus énekesmadárrá váltak, és széles körben használták azokat a különbözõ területeken, ideértve az 1,2-es toxikológiát, a 3-as viselkedést, a memóriát és a 4,5,6-os tanulást, az összehasonlító neuroanatómiát 7,8-at és a 9.10-es nyelvfejlõdést. A zebrapinty, mint egyetlen szekvenált genommal rendelkező énekesmadár, lehetővé teszi a Passeriformes rend genetikai és molekuláris vizsgálatát, amely az ismert madárfajok több mint 50% -át képviseli 11, 12,13.
Annak ellenére, hogy felnőtt és fiatalkori zebra-pintyeket sokféle területen alkalmaznak, kevés vizsgálatot végeztek a zebra-pinty embriókon, különösen a fejlődés korai szakaszában. Ez annak a petesejteknek és az embrióknak a kis méretének, valamint a 14,15,16 mintaszervezetként való újabb státuszának tulajdonítható, amelyekben a csirkét (Gallus gallus domesticus) korábban 17.18.19.20-ként alkalmazták. .21 uralkodó modellrendszer. Nem csókos hallgatókként azonban a csirkék nem alkalmas modellrendszer a vokális tanulás genetikai alapjainak, a vokális tanulás, az örökölhetőség, a viselkedés és a tanulásban részt vevő bazális ganglion-kortikális áramkörök tanulmányozásához.
Fontos megjegyezni, hogy a zebra pinty embriók sokkal finomabbak és könnyebben károsíthatók, mint a csirke embriók a boncolás és a molekuláris eljárások során. Különösen nagyobb gondosságra van szükség a zebra-pinty embriók permeabilizációs lépéseinek végrehajtásakor. Erős mosószerek és enzimek, amelyek nem károsítanák a csirke embriót, károsíthatják a zebra pinty embriókat. Az általános gondozás szempontjából szükséges, hogy az inkubátorba helyezés előtt a zebra-pinty tojásokat kis csészékbe rakják, hogy megakadályozzák azok törését az inkubálás során.
A zebrai pintyek viselkedéstanulmányoknak vannak kitéve, fogságban egész évben könnyen és szaporodva reprodukálódnak, és hangosan tanulnak. Ezek a tulajdonságok lehetővé teszik a zebra pinty használatát annak a modellszervezetnek az igényére, amely integrálja a nyelv fejlődési, genetikai és viselkedési aspektusait. Az alábbiakban részletezett boncolási módszerek, valamint a közelmúltban kifejlesztett zebra-pinty-specifikus stádium-útmutató 22 teszik a zebra-pintyet egyre hasznosabb szabványosított organizmus-fejlődési modellvé. Az embriók megszerzése a korai szakaszban azonban ijesztő lehet. Ez a protokoll lehetővé teszi a kutatók számára, hogy könnyen megszerezzék a korai stádiumú embriókat. A zebra-pinty komplex viselkedésének korai fejlődését és molekuláris fejlődésének alapját, vagy más kisméretű madár madarak fejlődésének toxikológiai hatásait vizsgáló tanulmányok hasznosnak találják ezt a boncolási módszertant.
Jegyzőkönyv
Etikai nyilatkozat: A módszereket a William és Mary Főiskola tenyésztelepének háziasított zebra pintyén hajtották végre. Minden eljárás követte az RSPCA 23 irányelveit, és a William és Mary College OLAW (Laboratóriumi Állatvédelmi Iroda) Állatvédelmi Biztosítója (# A3713-01) hagyta jóvá, és az Intézményi Állatgondozási és Felhasználási Bizottság (IACUC) jóváhagyásával rendelkezett (# 2013-06 -02-8721-dacris).
1. Tojásgyűjtés és inkubálás
2. Az embrió eltávolítása a petesejtből
3. Az embriók elválasztása az extra-embrionális szövetektől
4. EdU sejtproliferációs vizsgálat. Az EdU beépítése és kimutatása Zebra Finch embriókban.
5. Az EdU kattintson a Reaction Protocol elemre
A következő lépéseket üvegüvegeken hajtják végre.
Reprezentatív eredmények
A boncolás előtt az EdU-t a 2. napon egy tojásba injektálják, és egy éjszakán át inkubálják. A 16 22 stádiumú embrió boncolása és rögzítése után az EdU-t "click" kémia segítségével vizualizálták, lehetővé téve a szaporodó sejtek detektálását 6. ábra (A, B, C). Fontos, hogy gondosan figyelemmel kísérjük az időpontokat, amikor a tojásokat az inkubátorba helyezzük, és a boncolások során, mivel a metilhiganynak való kitettség vagy az EdU assay végrehajtása megzavarhatja a fejlődés progresszióját. Az injekciót a 0. nap korai szakaszában végeztük, amely a betakarítás napja volt az 1.3 lépésben leírtak szerint. Ezt az embriót kb. 38 órával később boncoltuk (7-22. Szakasz). A túlélési arány körülbelül 90% -os volt (azonos sebességgel, mint a kontroll embrióké), amíg az injekció mennyisége 478 nl alatt volt.
Ez a módszertan lehetővé teszi a boncolást a kiváló minőségű RNS kivonása céljából is. A 16-os stádiumú 22 embriók boncolása után RNS-extrakciót hajtottunk végre a gyártó protokollja szerint, optimalizálás nélkül, amint azt a 7. ábra. A sárgája membránjának eltávolítása felesleges volt az RNS extrakcióhoz és az azt követő QRT-PCR alkalmazásokhoz.
Megjegyzés: Az összes embriófigura úgy van orientálva, hogy az elülső és a hátsó régió a képek tetején, illetve.
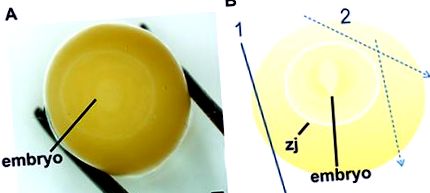
1. ábra A zebra-pinty embriók felkutatásának és boncolásának eljárása, 1-10. Szakasz 22. Keresse meg az embriót a sárgájának óvatos gördítésével, amíg a gyenge fehér korong nyilvánvalóvá nem válik (NAK NEK). Amint az embrió a tojássárgája közepén van, a tojássárgáját szakaszosan felboncolják (B) amelyben az első bevágás enyhíti az 1 vitellin membrán nyomását, és az ezt követő vágások (2) határolják a vitellin membránhoz tapadt csatlakozási zónát (zj). A méretarány 1 mm-t képvisel.
2. ábra A vitellin membrán eltávolítása és az embrionális struktúrák láthatósága. Miután eltávolította az embriót a tojássárgájáról, helyezze az embriót egy 4% PFA-t tartalmazó Petri-csészébe. Ha in situ hibridizációt kell végrehajtani, az embrionális struktúrák láthatósága elengedhetetlen, és a sárgája membránjának eltávolításával érhető el. (NAK NEK). Fogja meg a sárgája membránját rendkívül finom hegyes csipesszel, és óvatosan távolítsa el az embriótól, ha szükséges, az embriót közvetlenül a legkülső szélén manipulálja.(B). A sárgája membránjának eltávolítása növeli az embrionális struktúrák tisztaságát, és lehetővé teszi az embriók képalkotását vagy feldolgozását in situ hibridizációval (C). A méretarány 1 mm-t képvisel. Kattintson ide az ábra nagyobb változatának megtekintéséhez.
3. ábra Teljes in situ hibridizáció metilhiganynak kitett zebra-pinty embriók kifejlesztésében. Az orthodenticle homeobox 2 (Otx2) expressziós mintáit 0,0 ppm metilhiganynak kitett embriókban jellemeztük (A, A ') és 2,4 ppm metil-higany (B, B ') a szülők étrendjén keresztül. Az Otx2 doRsaI (A) és ventrális (A ') expressziója az optikai és a középagyi vezikulákon keresztül látható a 12-22. Szakaszban. A kezelési csoport embrióit ugyanabban az időpontban boncoltuk, de a dorzálisnál késleltetett fejlődésük késett. a fej szerkezeteinek (B) része és ventrális nézete (B '), amelyek a 11. szakaszra jellemzőek 22 Rövidítések:. MB, középagy; op, látóhólyag. A méretarány 1 mm-t képvisel.
4. ábra Teljes összeállítás in situ Hibridizáció metilhiganynak kitett zebra-pinty embriók kifejlesztésében. Az orthodenticle homeobox 2 (Otx2) expressziós mintázatait a 6. szakaszban 22 embriót jellemeztük 0,0 ppm metilhiganynak (A, A ') és az 5. stádiumú 22 embriót 2,4 ppm metilhiganynak kitéve (B, B ') a szülők étrendjén keresztül. Rövidítések: am, a mezoderma elülső széle; Nem, notochord, notochord mesoderm; po, proamnion, elülső blastopore; ps, primitív vonal 22. A méretarányok 1 mm-t képviselnek.
5. ábra Az összes helyszíni szerelés A hibridizációt zebra pinty embriókban hajtjuk végre az érzékelő szondával. (NAK NEK) 5. szakasz 22 embrió. (B) 6. korai szakasz 22 embrió. (C) 11. szakasz 22 embrió. A méretarány 1 mm-t képvisel.
6 "src ="/files/ftp_upload/51596/51596fig6highres.jpg "/>
6. ábra Edu beépítése és védelme a zebra pinty embriókban. Az EdU "click" kémiai eljárást alkalmazták a 16 22-es embrionális stádiumban szaporodó sejtek kimutatására (A, B, C). Az EdU beépül a DNS-be a 26., 27. timidin helyén, és kémia segítségével detektálható. Kattintson a 27. gombra. A szaporodás jól látható a somiták és a farok oldalsó szélein. A panel NAK NEK azt mutatja, hogy a proliferáció kizárólag az embrió hátsó részén fordul elő, és egyedi proliferáló sejteket is mutat. A panel B mutatja az egész embrió szaporodási helyeit. A panel C bemutatja az elülső régiót, és részletesebben mutatja az erősen szaporodó telencephalont (TE). Rövidítések: af, magzatvíz; FLB, a szárny vázlata; hlb, hátsó végtag rügy; le, lencse vezikulája; ms, középagy; mt, Metencephalon; opt, optikai pohár; pa, garatív; sm, somit mesoderma; tb, tailbud; tencephalon. A méretarány 1 mm-t képvisel. Kattintson ide az ábra nagyobb változatának megtekintéséhez.
7. ábra A boncolt zebra-pinty embriókból kivont RNS minősége. A kontrollt (0,0 ppm) és 1,2 ppm metil-higany embriókat boncoltuk és flash-fagyasztással végeztük a 3.8. Lépésben leírtak szerint. Mindegyik sáv az egyes kezelési csoportok két homogenizált embriójából kivont RNS-t mutat.
Vita
Az embriológiai állomásvezető 22 közelmúltbeli fejlesztése és a zebra pinty genom feljegyzései a fejlesztési vizsgálatok kívánatos modellszervezetévé teszik. A zebra-pinty embriók kis mérete és törékenysége azonban az 1–10 22 lépésben 3 és 7 mm között nehézzé teheti a boncolást 11, 14. Az embriók megkeresése és a sárgája felszínéről való tiszta eltávolítása kihívást jelenthet. Ez a protokoll elegendő részletességgel szolgál az eljárás egyszerű végrehajtásához. Ez a protokoll olyan kritikus lépéseket mutat be, amelyek általában nem ismertek, de szükségesek a sikeres boncoláshoz. Például elengedhetetlen, hogy az embrió és a súlyú papírlap között hagyjon egy kis sárgáját, hogy megakadályozza a tapadást.
Az embrió azonosítása és eltávolítása egyaránt nehéz lehet. A sárgája felszínén található embrió azonosításával kapcsolatos hibák elhárításához világítson közvetlenül a sárgáján, miután eltávolította a tojásból, és 45 ° -os szögben nézze meg a sárgáját, hogy megtalálja az embriót. Miután megtalálta az embriót, vágja le a tojássárgáját mérlegpapírra, ügyelve arra, hogy ne szakítsa el az embriót.
Ha más alkalmazások anatómiai különbségek képalkotását, in situ hibridizációt vagy sejtproliferációs vizsgálatokat tartalmaznak, fontos a sárgája membránjának eltávolítása az 1-8. 22 lépésben a struktúrák jobb megjelenítéséhez. Ha a korai szakaszban nehézségei vannak a sárgája vagy a sárgája membránjának eltávolításával, rögzítse az embriót 4% PFA-ban, mielőtt 1X PBS-ben mossa, hogy csökkentse az embrió törékenységét. Először eltávolítva a sárgája membránját a boncolás során, ahogy azt leírtuk, a struktúrák jól láthatóak és épek a zebra-pinty embriókban az in situ hibridizáció elvégzése után.
Az edu korlátja, hogy a 478 NL feletti dózismennyiségek beadása embrionális mortalitást eredményez. A széles dózistartomány azonban lehetővé teszi a proliferatív sejtek eltérő mértékű jelölését.
A készletben alkalmazott "kattintási" reakció a katalizált réz (I) -alkin-azid-ciklidradíció (Cu (I) AAC). Ebben a specifikus reakcióban egy timidin-alkin-analógokat (UDE) tartalmazó molekula aktívan osztódó sejteket épít be. Az UDE alkincsoportja kiemelkedik a DNS spirális szerkezetéből, és egy zöld, fluoreszcens molekulához konjugált azid molekula hatásával detektálható, amely a szabad alkin csoporthoz kötődik. A zöld fluoreszcencia újonnan szaporodó sejteket mutat az embrióban. Az azid- és alkincsoportok bioortogonalitása megakadályozza a nem specifikus festődést, mivel ezek a reaktív fajok nincsenek természetes módon jelen az organizmusokban. Továbbá, mivel a DNS-t nem kell denaturálni a reakció kialakulásához, ezért könnyebben elvégezhető egy részletesebb DNS-függő elemzés 27.
Közzétételek
A szerzőknek nincs mit közölniük.
Köszönetnyilvánítás
A szerzők köszönetet mondanak finanszírozási forrásaiknak, a William és Mary Egyetem Howard Hughes Orvostudományi Egyetem Természettudományi Oktatási Programjának; Adománytámogató: NIH (SMS); Támogatás száma: R15NS067566. Elismerik továbbá a Vilmos és Mária Főiskola, a Biológiai Tanszék, valamint a Művészeti és Tudományos Főiskola támogatását az állatok gondozásában nyújtott segítségért.
- KOMMUNIKÁCIÓ A Paramount Pictures és a Coke Zero jelen vannak Mission IMPOSSIBLE-GHOST PROTOCOL (1)
- A mediterrán étrendhez való ragaszkodás összehasonlító elemzése lányok és serdülők között, akik teljesítenek
- Hozzon létre egy alkalmazást az Android Android Blackberry iPhone Mobile App Development Freelancer számára
- Ketogén diéta spanyolul
- BOE-A-2004-19313 dokumentum
