Fabiola Hernández-Rosas 1, Juan Santiago-García 2 *
1 doktorandusz, Biológiai Kutatások Intézete, Universidad Veracruzana az orvosbiológiai tudományokban, Biológiai kutatások intézete.
2 Teljes munkaidős tudományos főmunkatárs, Biológiai Kutatások Intézete, Universidad Veracruzana.
* Levelezés: Juan Santiago-García
Biológiai Kutatások Intézete, Universidad Veracruzana
Email: [e-mail védett]
Absztrakt
A cirkadián ritmusok olyan biológiai ritmusok, amelyek időtartama közel 24 óra, ezek szabályozzák napi anyagcsere-, hormon- és viselkedési aktivitásunkat. Ezeket az agyban és a perifériás szövetekben ritmikusan kifejeződő géncsoport, az úgynevezett óra gének belső transzkripciós aktivitása állapítja meg. A legújabb epidemiológiai vizsgálatok arra utalnak, hogy a cirkadián ritmuszavarok kockázati tényezőt jelentenek az emberekben a rák kialakulásában. Érdekes módon a Per2 óra gén mutáns egereiről kiderült, hogy daganatok alakulnak ki. Ezekkel a bizonyítékokkal elemezték a rák különböző típusainak biopsziáit emberekben, amelyek azt mutatták, hogy a Per1, Per2 vagy Per3 gének expressziója jelentősen csökken, a normál szövethez képest. Ebben a cikkben áttekintjük azokat a bizonyítékokat, amelyek összefüggést sugallnak a cirkadián ritmus változásai és az óra gének expressziója között a rák kialakulásával.
Bevezetés
Az élet ritmikus jelenség. Az élőlények tevékenysége és funkciói periodikus vagy ritmikus variációkként és nem folyamatos folyamatként nyilvánulnak meg. Ezeket a variációkat biológiai ritmusnak nevezzük. A természetben változatos biológiai ritmusok figyelhetők meg; azokat, akiknek a periodikája kevesebb, mint 24 óra, ultradiánnak nevezzük, például: ételfogyasztás, pulzus, pihenés és aktivitás stb. A maguk részéről a 24 órához közeli periodicitású biológiai ritmusokat cirkadiánnak nevezik, mint például: az alvás és az ébrenlét ciklusa, bizonyos hormonok felszabadulása stb. Míg az egy napnál hosszabb periodikusságú biológiai ritmusokat infradiánoknak nevezzük, mint például a menstruációs ciklus, az ösztrikus ciklus, a hibernáció esetében.
Az emlősöknél a cirkadián ritmust egy központi vagy "master" biológiai óra generálja, amely a központi idegrendszerben az úgynevezett suprachiasmatic nucleusnak (NSQ) nevezett hipotalamusz struktúrákban található, valamint a különböző szövetek sejtjeiben elhelyezkedő óráknak, amelyek oszcillátorokként ismertek. Perifériák [1, 2]. Ezek az órák együttesen olyan rendszerek, amelyek képesek időbeli rendet létrehozni a szervezet tevékenységeiben, szabályos periódussal oszcillálnak, és ezeket a rezgéseket belső időbeli referenciaként használják számos testi funkció biológiai ritmusának szabályozására, például: alvás ébredés, pihenés és aktivitás, testhőmérséklet, vérnyomás, szívteljesítmény, oxigénfogyasztás, folyadékegyensúly és endokrin mirigy szekréciója [1,3]
Óragének és a cirkadián óra molekuláris mechanizmusa
A gyümölcslégyben (Drosophila melanogaster) végzett mutagenezis vizsgálatok lehetővé tették a cirkadián ritmus változásával rendelkező mutáns legyek azonosítását. Ezeknek a mutánsoknak a jellemzése és elemzése lehetővé tette néhány olyan gén felfedezését, amelyek részt vesznek a cirkadián ritmus létrehozásában és fenntartásában ezekben a rovarokban. Ezt a géncsoportot hívták óragéneknek vagy „óragéneknek”. Ezt követően homológ géneket klónoztak emlősökben, és mutáns hörcsögökből vagy egerekből új óragéneket azonosítottak. Emlősökben legalább kilenc óra gént írtak le: Per1, Per2, Per3, Cry1, Cry2, Clock, Bmal1, Kazein-kináz Ie (CkIe) és Rev-Erb_ [1].
A központi cirkadián óra és a perifériás cirkadián oszcillátorok molekuláris mechanizmusa magában foglalja az óra gének ritmikus transzkripcióját szabályozó pozitív és negatív jelek kölcsönhatását. Ez a géncsoport felelős a cirkadián aktivitás ellenőrzéséért minden élőlényben [1,4]. Ezen gének expresszióját két transzkripciós aktivációs/repressziós hurok szabályozza. A pozitív szignálhurkot a Clock és a Bmal1 gének, míg a negatív hurkot a Per és Cry gének irányítják [1,5].
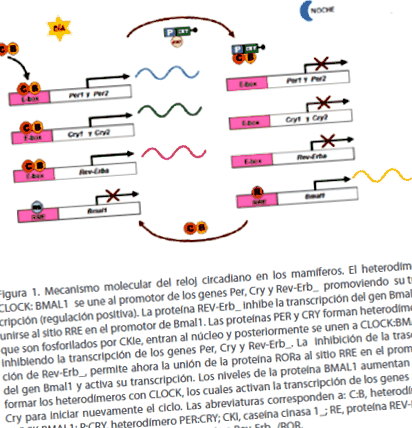
A legszélesebb körben elfogadott modell a cirkadián óra molekuláris mechanizmusának magyarázatára az emlősöknél az egér. Ha az egér központi cirkadián órájának (NSQ) működését egy 24 órás cirkadián kontextusba helyezzük, a következő következik: a cirkadián nap elején (kora reggel) a Per gének és Cry transzkripciója a CLOCK: BMAL1 fehérjéket alkotó heterodimerek aktiválják, amelyek az E box néven ismert szabályozó szekvenciákhoz kötődnek, és amelyek a Pery Cry gének promotereiben találhatók, hogy aktiválják transzkripciójukat. Ezeknek a géneknek a hírvivői a citoszolban a megfelelő fehérjékké (PER és CRY) transzlálódnak. A cirkadián nap közepe felé (éjszaka kezdete) a PER és CRY fehérjék asszociálódnak és heterodimereket képeznek (PER: CRY), amelyeket a CKI enzim foszforilez, majd transzlokálódik a sejtmagba, ahol felhalmozódnak. PER: CRY heterodimerek elkülönítik az ÓRÁT: A BMAL1 heterodimerek zavarják a Per és Cry gének promóter helyéhez való kötődésüket, gátolva transzkripciójukat. Ezért a PER és a CRY fehérjék negatív szabályozóként működnek [1,5].
A CLOCK: BMAL1 heterodimerek szintén aktiválják a Rev-Erb_ néven ismert nukleáris árva receptorokat kódoló gén transzkripcióját. A magba kerülve a REV-ERB_ fehérje a Bmal1 gén promóteréhez kötődik, és elnyomja annak transzkripcióját, aminek következtében a Bmal1 mRNS szintje csökken. Másrészt, amikor a PER: CRY fehérjék dimerjei belépnek a sejtmagba, és gátolják a Per és Cry transzkripcióját, gátolják a Rev-Erb_ transzkripcióját is, és közvetett módon stimulálják a Bmal1 gén transzkripcióját. REV-ERB_ hiányában a RORa fehérje (RAR-rokon árva receptor) a Bmal1 gén promóteréhez kötődik és aktiválja transzkripcióját. Következésképpen a BMAL1 fehérje szintje nő az éjszaka végén, elősegítve a CLOCK: BMAL1 heterodimerek kialakulását, amelyek aktiválják a Per és Cry gének transzkripcióját, hogy újraindítsák a ciklust (1.ábra) [1.5].
1.ábra. A cirkadián óra molekuláris mechanizmusa emlősökben. A CLOCK: BMAL1 heterodimer kötődik a Per, Cry és Rev-Erb_ gének promoteréhez, elősegítve azok transzkripcióját (pozitív szabályozás). A REV-Erb_ fehérje gátolja a Bmal1 gén transzkripcióját azáltal, hogy a Bmal1 promoter RRE helyéhez kötődik. A PER és CRY fehérjék heterodimereket képeznek, amelyeket a CKIe foszforilez, belépnek a sejtmagba, majd kötődnek a CLOCK: BMAL1-hez, gátolva a Per, Cry és Rev-Erb_ gének transzkripcióját. A Rev-Erb_ transzkripció gátlása lehetővé teszi a RORa fehérje megkötését az RRE helyhez a Bmal1 gén promóterében, és aktiválja annak transzkripcióját. A BMAL1 fehérje szintje növekszik, így a CLOCK segítségével heterodimerek képződnek, amelyek aktiválják a Per és Cry gének átírását a ciklus újrakezdéséhez. A rövidítések a következőknek felelnek meg: C: B, ÓRA: BMAL1 heterodimer; P: CRY, heterodimer PER: CRY; CKI, kazein-kináz 1_; RE, REV-ERB_ fehérje; R, RORa fehérje; RRE, Válaszelem a Rev-Erb_/ROR-ra.
Az átírás CLOCK: BMAL1 és PER: CRY dimerjeinek ellentétes hatásai biztosítják, hogy a Per és Cry hírvivők antifázisban oszcilláljanak a Bmal1 messengerrel. Ezen gének expressziójának maximális és minimális szintje 24 órához közeli periodicitással fordul elő, így létrehozzák a cirkadián ritmust az organizmusokban. Például az NSQ-ban a Bmal1 expresszió maximális csúcsa az éjszaka közepén, míg a Per és Cry hírvivők maximális csúcsa délben következik be [1].
Cirkadián órák a perifériás szövetekben
A cirkadián órák vagy oszcillátorok sokféle perifériás szövetben léteznek, hasonlóan azokhoz, amelyek az NSQ idegsejtjeiben működnek [14,15,16]. Mind az NSQ neuronok, mind a perifériás szöveti sejtek, mind a tenyésztett fibroblasztok az óragén expressziójának időbeli mintázatát mutatják. Egy újabb tanulmánysorozat kimutatta, hogy a Per, Cry és Bmal1 gének ritmikus expressziót mutatnak különböző szövetekben, például: májban, szívben, tüdőben, vesében, tenyésztett fibroblasztokban és másokban [1,2,15,16]. Az NSQ-val ellentétben azonban a perifériás emlősök szövetében az óra gének expressziójában a cirkadián oszcillációk gyorsan csökkennek, amikor explantátorként tartják fenn őket a kultúrában. A perifériás patkányszövetekben az óragének cirkadián expressziója 2-7 napon belül elvész, míg a tenyésztett fibroblasztokban 3-4 ciklus után [15,17]. Ezzel szemben az óragének cirkadián expressziója a tenyésztett NSQ-ban egy hónapnál tovább fennmarad [17,18]. Ez azt feltételezte, hogy az NSQ az a belső vagy cirkadián ritmusú mester vagy központi óra, amely különféle idegi és humorális jelek révén szinkronizálja a perifériás szövetekben és más agyi régiókban elhelyezkedő cirkadián oszcillátorok aktivitását.
Másrészről, a különböző jelek, mint például a glükokortikoid analógok beadása és az etetési ütemterv megváltozása, kimutatták, hogy megváltoztatják a májban és más perifériás szövetekben az óra gén expressziójának cirkadián mintáit, de nem befolyásolják azok expresszióját. az NSQ [15-17, 19, 20]. Ez azt sugallja, hogy bizonyos metabolikus vagy fiziológiai körülmények között a perifériás oszcillátorok ritmusának helyi szabályozása leválasztható az NSQ vezérléséről, hogy alkalmazkodjanak az adott körülményekhez anélkül, hogy befolyásolnák a központi órát. Ez pedig lehetővé tenné a sejtfiziológia optimalizálását oly módon, hogy bizonyos gének expressziója korlátozott legyen, ha azok termékeire szükség van. Amikor ezek a körülmények megszűnnek, az NSQ vissza tudja szinkronizálni a perifériás oszcillátorokat a normális ritmusukra [2,16,17,19].
Óragének és rák
Annak érdekében, hogy megértsük az egyes óragének működését a cirkadián ritmusok létrehozásáért felelős molekuláris mechanizmusban, kifejlesztettek egy mutáns vagy knock-out egér sorozatát, amelyben ezeknek a géneknek a funkciója van. Ezek a mutáns egerek a mozgásszervi aktivitás és a vízbevitel cirkadián ritmusának elvesztését mutatják. Meglepő megállapítás történt a Per2 óra gén mutáns egereinek kifejlesztésekor, amelyek a cirkadián ritmus elvesztése mellett nyálmirigy hiperpláziákat, limfómákat és bőrteratomákat fejlesztettek ki [13]. A mutáns Per2 egerek gamma-sugárzással, a DNS-t károsító szerrel történő kezelésével felgyorsult a tumor fejlődése, ami idő előtti halált okozott ezekben a rágcsálókban. Ezzel szemben ezt a fenotípust nem figyelték meg az azonos kezelésnek alávetett kontroll (nem mutáns) egereknél [13].
Ezen megfigyelések alapján a világ különböző kutatócsoportjai vállalták az óragének expressziójának jellemzését az emberek különböző ráktípusainak biopsziáiban. Ezekben a vizsgálatokban az óragének, különösen a Per1 és Per2 gének expressziójának csökkenését találták az emlőrákban [21,22], a tüdőrákban [24], az endometrium rákban [25], a prosztatarákban [ 26], hasnyálmirigyrák [27], többek között (Asztal 1).
Asztal 1. A Per gének kifejeződése a rák különböző típusaiban
A Per gének expressziójának csökkenését rák biopsziákban megpróbálták elemezni, ezeknek a géneknek a metilációs mintáit elemezték, mivel ismert, hogy a promóter metiláció CpG szekvenciákban epigenetikus mechanizmust jelent, amely szabályozza a génexpressziót. E tekintetben azt találták, hogy a hPer1 gén promoterben található CpG helyek az emlőrákos esetek több mint 50% -ában metilálódnak, ez magyarázza expressziós szintjük csökkenését [22]. Hasonló vizsgálat krónikus myeloid leukémiában szenvedő betegeknél feltárta, hogy a hPer1, hPer2 és hPer3 gének promóterhelyének metilációja közvetlenül korrelál e gének expressziójának csökkenésével [23,28]. Ez a bizonyíték arra utal, hogy a Per gének expresszióját részben epigenetikus mechanizmusok szabályozzák.
A Per1 és Per2 gének szintén tumorszuppresszorok
A sejtszaporodás elengedhetetlen folyamat a test összes szövetének és szervének kialakulásához, helyreállításához és megfelelő működésének fenntartásához. A tumorszuppresszorokként ismert gének felelősek a sejtek proliferációjának és halálának ellenőrzésében szerepet játszó folyamatok szervezéséért egy szervezetben. Ezek a gének a sejtproliferáció negatív szabályozóiként működnek, ha nincsenek jelen vagy a mutációk miatt inaktívak, megakadályozzák a sejt normális szaporodását, megszerezve a tumorsejtekre jellemző proliferációs tulajdonságokat.
2. táblázat. A Per1 és Per2 gének expressziójának változásai a rákos sejtvonalakban
2. ábra. A Per1 és Per2 gének ellenőrző pontokon vesznek részt, amelyek megállítják a sejtek szaporodását. A séma különböző pontokat mutat be, amelyekre vonatkozóan kísérleti bizonyítékok gyűltek össze a Per-gének esetleges részvételéről a sejtciklus szabályozásában. A rövidítések a következőknek felelnek meg: Cdk, ciklin-függő kináz; ATM, mutált Ataxia Telangiectasia Kinase; ATR, ATR fehérjével rokon kináz; Chk1, Checkpoint kinase 1; Chk2, Checkpoint kinase 2; Gadd45a 45 alfa fehérje növekedés indukciójához, kimutatásához és DNS károsodásához; Cdc25, sejtosztódási ciklusú foszfatáz 25.
Gery és munkatársai (2006) által megszerzett egyéb friss adatok azt mutatták, hogy a Per1 kölcsönhatásba lép az ATM és Chk2 kinázokkal, amelyek részt vesznek a DNS károsodására adott válaszmechanizmusokban [24]. Ezek a kinázok jelentős hatással vannak a sejtciklus ellenőrzési pontjaira és a DNS-károsító szerekre adott válaszra. Amikor az ATM-kináz kimutatja a DNS károsodását, biokémiai aktivitásának növelésével reagál, amely módosítja a többi fehérjét, amelyek mindegyike felelős a DNS károsodásának helyreállításában, a sejtciklus blokkolásában és az apoptózis kiváltásában.
A cirkadián ritmus rendellenességeivel összefüggő patológiák Az ember élettani változások sorozatát mutatja be a cirkadián nap folyamán (24 óra). Például a nap elején bekövetkező hormonális változások, főként a hipotalamusz-hipofízis-mellékvese tengely szintjén, katekolaminok felszabadulását eredményezik a véráramban, ennek megfelelő aktiváló hatással a szerves funkciókra. Ez lehetővé teszi, hogy a test ébren maradjon és aktív legyen az izomtónus és az idegi aktivitás növekedése miatt. A katekolaminok felszabadulása az éjszaka folyamán csökken, ami szintén csökkenti aktiváló hatását, és bekövetkezik az alvás, amely időszakban a tudatos intellektuális funkciók törlődnek, hogy utat engedjenek az öntudatlanoknak. Ezért a cirkadián biológiai szerkezet integritása kritikus a hatékony biológiai és kognitív működés szempontjából.
A rák kronobiológiájának és kronoterápiájának perspektívái
Következtetések
A cirkadián ritmus megváltozása kimutatták, hogy kockázati tényező a különféle kórképek, köztük a rák kialakulásában, ami arra utal, hogy a cirkadián ritmus integritása fontos szempont az egészség szempontjából. Megállapították továbbá, hogy bizonyos óragének, például a Per-gének expressziójának hiányosságai hiányosságokat eredményeznek a sejtciklus szabályozásában és a DNS károsodására adott válaszban, valamint rágcsálókban kialakuló daganatokban. . Más szóval, a cirkadián óra nemcsak különféle biológiai és viselkedési folyamatokat szervez, hanem alapvető szerepet játszik a sejtfiziológiában is. További vizsgálatokra van azonban szükség a cirkadián óra szerepének tisztázásához a sejtproliferációban, az apoptózisban és a rosszindulatú transzformáció mechanizmusaiban. Ezek a vizsgálatok nagy jelentőséggel bírnak, mivel lehetővé teszik értékes ismeretek megszerzését a rákellenes új terápiás lehetőségek kifejlesztéséhez.
Köszönöm
A Nemzeti Tudományos és Technológiai Tanácsnak (CONACYT) a Fabiola Hernández-Rosas (munkatárs: 223273) ösztöndíjért és a PROMEPSEP-nek a Juan Santiago-García (PTC-270) számára biztosított finanszírozásért.