Tekintse meg az e médiumban megjelent cikkeket és tartalmakat, valamint a tudományos folyóiratok e-összefoglalóit a megjelenés idején
Figyelmeztetéseknek és híreknek köszönhetően mindig tájékozott maradjon
Hozzáférhet exkluzív promóciókhoz az előfizetéseken, az indításokon és az akkreditált tanfolyamokon
Kövess minket:
- Bevezetés
- Anyagok és metódusok
- Eredmények
- Vita
- Bevezetés
- Anyagok és metódusok
- Ebhg készítése bfgf-vel vagy anélkül
- Kísérleti állatok
- Kísérleti aaa indukciója
- Kezelési csoportok
- Szövettani elemzés
- Statisztikai elemzés
- Eredmények
- A nap változásai az 5 csoportban
- Szövettani elemzés
- Vita
- Bibliográfia
A hasi aorta aneurizma (AAA) gyakori és életveszélyes rendellenesség, amelyet az aortafal extracelluláris mátrixának roncsolása és szintézise közötti egyensúlyhiány jellemez. Az aneurysma kialakulása krónikus transzmurális gyulladással, a simaizomsejtek (SMC) populáció kimerülésével és a metalloproteináz mátrix (MMP) túlzott termelésével jár, ami az elasztin és az 1, kettő kollagén rendellenes lebomlását okozza. Az AAA standard kezelése a vaszkuláris implantátumok elhelyezésével végzett műtéti korrekció, valamint az aneurysma endovaszkuláris helyreállítása, mindez azzal a céllal, hogy megakadályozza az AAA halálos repedését. Az aneurysma patológia stabilizálására és a további terjeszkedés vagy repedés megakadályozására azonban még mindig nincs hatékony orvosi kezelés.
Az itt leírt vizsgálatban patkányokat kísérleti AAA-val kezeltünk zselatin-hidrogél (EBHG) vagy beépített bFGF-et tartalmazó EBHG-vel, hogy megvizsgáljuk ezeknek a kezeléseknek a kísérleti AAA progressziójára gyakorolt hatását.
Anyagok és módszerek EBHG előállítása bFGF-vel vagy anélkül
Rekombináns humán bFGF-et 9,6 izoelektromos ponttal szállított a Kaken Pharmaceutical (Tokió, Japán). Az EBHG-t a korábban leírt módon állítottuk elő13. Az EBHG-t savzselatin 4,9 izoelektromos ponttal való keresztkötésével készítettük. Lemezbe öntötték (15 x 7 x 2 mm) és liofilizálták. Mielőtt az EBHG-t az aortára helyeztük, a liofilizált EBHG-t vizes oldattal bFGF-fel vagy anélkül 1 órán át áztattuk, így EBHG-t kaptunk bFGF-el vagy anélkül. Ezt a zselatin szivacslapot 2 hét alatt tervezték lebomlani.
Kísérleti állatok
Hím Sprague-Dawley patkányokat (250-400 g) kaptunk a CLEA-tól (Tokió, Japán), és felhasználtuk a kísérletekhez. Ezt a vizsgálatot a Tohoku Egyetem Orvostudományi Doktori Iskolájának Állatgondozási Bizottsága engedélyezte. Az állatok gondozása megfelelt a Laboratóriumi állatok gondozására és használatára vonatkozó útmutató (National Research Council, Washington DC, 1996) rendelkezéseinek.
Kísérleti AAA kiváltása
A patkányokat i.p. injekcióval altattuk. nátrium-pentobarbitált (50-60 mg/testtömeg-kg: Dainippon Pharmaceutical, Osaka, Japán), és steril körülmények között egy középvonalas laparotómiát végeztünk. Az infrarenalis aorta 1 cm-es szegmensét izoláltuk, és az összes ágyéki artériát ligáltuk. Az aorta külső átmérőjét az elasztáz infúzió (DA előinfúzió) előtt mértük digimatikus féknyereggel (Mitutoyo, Kanagawa, Japán). Polietilén katétert (Becton Dickinson, Sparks, MD) illesztettünk a jobb külső iliac artériába, és haladtunk az izolált aorta felé. A proximális aortába egy atraumatikus szorítót helyeztünk, és a próba rögzítéséhez ideiglenes ligálást végeztünk a distalis aorta felett. Az izolált aortát 2,7 egység sertés I típusú hasnyálmirigy-elasztázzal (E-1250, tétel 84K7700; Sigma, St. Louis, MO) 60 percig infúzióval injektáltuk (TOP-5200; TOP, Tokió, Japán). Az elasztáz infúziója után a ligatúrát és a próbát eltávolítottuk, a jobb külső csípőartériát lekötve. A retroperitoneumot és a hasfalat lezártuk. A patkányokat a beavatkozás után a 14. napon újra megvizsgáltuk (14 DPI), és megmértük a maximális DA-t.
Kezelési csoportok
Az elasztáz infúzióval rendelkező kísérleti patkányokat véletlenszerűen 5 csoportra osztottuk a kezelések szerint: egy csoportot kezelés nélkül (kezeletlen csoport, n = 10), egy csoportot, amelyet EBHG-vel kezeltünk desztillált vízzel (EBHG csoport, n = 10), 3 EBHG-vel rendelkező csoportok különböző beépített mennyiségű bFGF-rel (EBHG csoport + 100 ng, EBHG csoport + 1 μg és EBHG + 10 μg; n = 10, 6 és 6). Ezeket az EBHG-ket a patkányok elasztázzal infúziós aortáira helyeztük, és a retroperitoneumot lezártuk.
3 patkánycsoport szövettani értékelését végeztük, beleértve a kezeletlen csoportot, a csak EBHG-t tartalmazó csoportot és a 100 ng EBHG-értékkel rendelkező csoportot (n = 6, ill. 6). A patkányokat a beavatkozás után a 14. napon felöltük; 4% paraformaldehid-oldatot foszfáttal pufferolt sóoldatban (PBS) 5 percig perfundáltunk a bal kamrán keresztül, és az eltávolított aortákat 2% -ig 4% paraformaldehid-oldattal PBS-ben rögzítettük, majd 100% etanolt adtunk hozzá. A mintákat paraffinba ágyazottuk, és 5 μm szövettani metszeteket kaptunk, amelyeket Verhoeff-van Gieson (VVG) festékkel festettünk elasztikus szálakra, és előállítottuk immunhisztokémiai vizsgálatukra. A festett rugalmas szálak/az átlagos terület arányát a VVG festésnél Image-J szoftverrel számoltuk (NIH, Bethesda, MD).
Az immunhisztokémiai vizsgálatot deparaffinizálás és rehidratálás után végeztük. A metszeteket 10 percig H202-vel kezeltük az endogén peroxidáz aktivitás blokkolására. Miután 1% szarvasmarha-szérumalbumint PBS-ben 30 percig blokkoltunk, a szövettani metszeteket egy primer antitesttel inkubáltuk egy éjszakán át 4 ° C-on, beleértve az egér monoklonális antitestjét az a-simaizomaktin (a-SMA) humán (Sigma) festésére. patkány CML és patkány bFGF elleni nyúlantitest (Santa Cruz Biotechnology, Santa Cruz, CA). Ezt követően az inkubálást biotinilezett szekunder antitesttel és avidin-biotin komplextel (Dako Cytomation, Glostrup, Dánia) végeztük a gyártó protokollja szerint. A szövettani metszeteket hematoxilinnel ellenfestettük. Negatív kontroll kísérleteket hajtottunk végre az elsődleges antitest helyettesítésével egy nem specifikus egér vagy nyúl immunglobulin G-vel. A mediál CML-sűrűséget az a-SMA pozitív sejtek átlagolásával határoztuk meg, 8 nagy teljesítményű mezőben, 2 szövettani metszet közül választva.
Az adatokat átlag ± standard hiba (SE) formájában mutatjuk be. Az eredményeket egy- vagy kétirányú varianciaanalízissel (ANOVA) értékeltük, statisztikai szignifikanciával Scheffe post hoc p-jához rendeltük az egyes csoportok összehasonlítását. A statisztikai elemzést StatView J-5.0 szoftverrel (SAS Institute, Cary, NC) végeztük.
Eredmények LAD módosítások az 5 csoportban
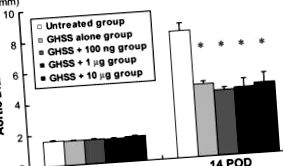
Az elasztáz infúzióval indukált kísérleti AAA-mal rendelkező patkányok 5 csoportjának DA-változásait az 1. ábra mutatja be. Az infúzió előtti DA-k meglehetősen hasonlóak voltak az 5 csoport között. Az elasztáz 60 percig tartó infúziója jelentősen megnövelte a DA-t 14 DPI-nél a kezeletlen csoportban 1,66 ± 0,02-ről 8,16 ± 0,50 mm-re. Ugyanezen feltételek mellett az összes kezelési csoport (csak EBHG, EBHG + 100 ng, EBHG + 1 μg és EBHG + 10 μg) szignifikánsan alacsonyabb DA-t mutatott 14 DPI mellett (4,66 ± 0,20, 4, 19 ± 0,15, 4,30 ± 0,54 és 4,52 ± 0,64 mm), mint a kezeletlen csoporté. Nem figyeltek meg szignifikáns különbségeket a DA-ban a csak a GABB csoport és a 3, GABB plusz bFGF-vel kezelt csoport között.
AD változások minden csoportban. Előinfúzió, az elasztáz infúzió előtt. Az adatokat a kezeletlen, az EBHG és az EBHG + 100 ng csoportok átlagaként ± SE n = 10 mutatjuk be; n = 6 az EBHG + 1 μg és az EBHG + 10 μg csoportokban. * p Szövettani elemzés
Megvizsgáltuk az α-SMA jelenlétét a rugalmas szálakban és a CML-t a középső rétegben VVG-festéssel, illetve immunfestéssel. A VVG festés a festetlen rugalmas szálak jelentős csökkenését mutatta ki a kezeletlen csoport átlagában (2a. És 2b. Ábra). Éppen ellenkezőleg, a rugalmas szálas festés jól megmaradt az EBHG és az EBHG + 100 ng csoportokban (2c. - 2f. Ábra). A festett rugalmas szálak területe és az átlag területe közötti arány, amelyet digitális számítógépes kép segítségével számítottak, szignifikánsan magasabb volt az EBHG-ben (23,8 ± 2,6%) és az EBHG + 100 ng-ban (24,8 ± 2,2%). mint a kezeletlen csoportban (16,8 ± 0,9%), bár az EBHG csoport és az EBHG + 100 ng közötti arányban nem figyeltünk meg szignifikáns különbséget (3. ábra). Az α-SMA antitesttel festett CML száma szignifikánsan magasabb volt az EBHG (81,8 ± 3,6/hpf) és az EBHG + 100 ng (86,1 ± 2,2/hpf) csoportokban, mint a kezeletlen csoportban (67,6 ± 3,2/hpf) ), bár a CML számában nem volt szignifikáns különbség az EBHG és az EBHG + 100 ng csoport között (4. és 5. ábra).
Az aorta falának mikroszkópos fényképei VVG festéssel rugalmas szálakra. A rugalmas szálak feketére vannak festve. Kezeletlen csoportok (a, b), önmagában az EBHG (c, d) és az EBHG + 100 ng (e, f). AD: adventitia; GHSS + 100 ng: biológiailag lebontható szivacs zselatin-hidrogéllel (EBHG) + 10 ng; GHSS önmagában: egyedül EBHG; M: jelentése; Kezeletlen: nem kezelik. Eredeti nagyítás x100 (képek a bal oldalon) és x400 (képek a jobb oldalon).
A VVG festés átlagának rugalmas szálak/terület arányát NIH Image-J szoftverrel számoltuk. Az eredményeket az egyes csoportok átlag ± SE-ként adjuk meg. n = 6 az összes csoportban. * p (a), egyedül az EBHG (b) és az EBHG + 100 ng (c). AD: adventitia; GHSS + 100 ng: biológiailag lebontható szivacs zselatin-hidrogéllel (EBHG) + 100 ng; GHSS önmagában: csak EBHG; M: jelentése; Kezeletlen: nem kezelik. Eredeti nagyítás x400.
Az aorta falának mikroszkópos fényképei a CML anti-α-SMA immunfestésével. A médiumban lévő CML citoplazmát barnára festjük. Kezeletlen csoportok (a), egyedül az EBHG (b) és az EBHG + 100 ng (c). AD: adventitia; GHSS + 100 ng: biológiailag lebontható szivacs zselatin-hidrogéllel (EBHG) + 100 ng; GHSS önmagában: csak EBHG; M: jelentése; Kezeletlen: nem kezelik. Eredeti nagyítás x400.
A mediális CML sűrűségét az α-SMA-ra pozitív sejtek száma alapján határoztuk meg 8 nagy teljesítményű mezőben, amelyeket két szövettani szakaszban választottunk meg. Az eredményeket átlagként ± SE, N = 6 mutatjuk be minden csoportban. * p (a), csak az EBHG (b) és az EBHG + 100 ng (c). AD: adventitia; GHSS + 100 ng: biológiailag lebontható szivacscsoport zselatin-hidrogéllel (EBHG) + 100 ng; GHSS önmagában: csak EBHG; M: jelentése; Kezeletlen: nem kezelik. Ezek az eredmények a bFGF-pozitív sejtek (citoplazma és sejtmag) növekedését tárják fel a táptalajban, valamint az egyedül az EBHG és az EBHG + 100 ng csoportok adventitiumai a kezeletlen csoporthoz képest. Eredeti nagyítás x200.
Anti-bFGF antitesttel immunfestett aorta falának mikroszkópos fényképei. Kezeletlen csoportok (a), csak az EBHG (b) és az EBHG + 100 ng (c). AD: adventitia; GHSS + 100 ng: biológiailag lebontható szivacscsoport zselatin-hidrogéllel (EBHG) + 100 ng; GHSS önmagában: csak EBHG; M: jelentése; Kezeletlen: nem kezelik. Ezek az eredmények a bFGF-pozitív sejtek (citoplazma és sejtmag) növekedését tárják fel a táptalajban, valamint az egyedül az EBHG és az EBHG + 100 ng csoportok adventitiumai a kezeletlen csoporthoz képest. Eredeti nagyítás x200.
Ezt a vizsgálatot eredetileg az EBHG és a beépített bFGF terápiás hatásainak vizsgálatára tervezték a kísérleti AAA progressziójára az egér AAA modelljének felhasználásával. Az EBHG-t alkalmazták a bFGF helyi és hosszú távú hatásainak fenntartására. Két AAA patkánycsoportot készítettünk, amelyek kontrollként működtek, köztük egy csoportot kezelés nélkül és egy másik csoportot, amelyet EBHG-vel kezeltek beépített bFGF nélkül, mivel az EBHG hatása a kísérleti AAA-ra nem volt egyértelmű. Míg az EBHG 'bFGF patkányok DA-értéke 14 DPI-nél szignifikánsan alacsonyabb volt, mint a kezeletlen patkányoké, a csak az EBHG-t tartalmazó patkányok 14 DPI-nél csaknem azonos DA-val rendelkeztek az EBHG + bFGF patkányokhoz viszonyítva. Eredményeink a bFGF dózisfüggetlen hatását is kimutatták. Ezek az eredmények arra engednek következtetni, hogy az EBHG az aortára helyezése jelentős terápiás hatást gyakorol az AAA progressziójára, míg a bFGF további terápiás hatása meglehetősen korlátozott volt.
A kísérleti AAA indukcióját elasztáz infúzióval kezdetben Anidjar és mtsai (17) végezték, akik arról számoltak be, hogy ennek a modellnek a kóros eredményei hasonlóak voltak az emberi AAA-hoz. Ebben a tanulmányban értékeltük a rugalmas szálakat és az átlagos CML-t, amelyek drámaian csökkentek a humán AAA-ban és a kísérleti AAA 1,17-ben. Eredményeink kimutatták, hogy a kezeletlen patkányokban a rugalmas szálak és a CML jelentősen csökkent, ahogyan azt a korábbi vizsgálatok leírták, míg a csak EBHG-vel kezelt patkányok jelentősen gyengítették a rugalmas szálak és a CML csökkenését. Az EBHG + bFGF kezelés szintén enyhítette ezt a csökkenést, de statisztikai különbséget nem tapasztaltunk az EBHG és az EBHG + bFGF patkányok között. Ezek az eredmények azt sugallják, hogy az EBHG önmagában javítja az aneurysma falat azáltal, hogy megőrzi a rugalmas szálakat és az SMC-ket, ezáltal alacsonyabb AD.
A bFGF hozzáadása kevés terápiás hatást fejtett ki ebben a vizsgálatban. Ezenkívül a bFGF dózisfüggő hatását nem figyelték meg a kísérleti AAA progressziójára. Bár ismert, hogy a bFGF elősegíti a különböző mezenhimális sejtek szaporodását, számos tanulmány arról számolt be, hogy a bFGF túlzott dózisa gátolja azok szaporodását, és hogy hatékonysága nem dózisfüggő 20,21. Ezért eredményeink azt sugallják, hogy az EBHG önmagában elegendő mennyiségű bFGF-et indukál a kísérleti AAA progressziójának gátlásához, és valószínűleg ez az oka a további hatás hiányának a bFGF beadása után.
A beépített bFGF-kel rendelkező zselatin-hidrogél terápiás értékét alaposan tanulmányozták az angiogenezissel 22, valamint a csont- vagy bőrregenerációval kapcsolatos kísérleti módszerrel, néhány klinikai alkalmazást megkezdve 24. Az EBHG-kezelés humán AAA-ban történő felhasználásához módszertani fejlesztésekre van szükség, amelyek lehetővé teszik annak kevésbé invazív módon történő beadását, például minilaparotomiával vagy laparoszkópos technikákkal. Mivel jelenleg nehéz a teljes hasi aortát elkülöníteni és az EBHG-vel burkolni az embereknél, ebben a vizsgálatban az EBHG-t a hasi aorta fölé helyeztük, anélkül, hogy becsomagoltuk volna. Valójában az EBHG elhelyezése az aortán elegendő hatást váltott ki. Ezért ez a tanulmány azt sugallja, hogy az AAA kezelésére elegendő az EBHG-t az aorta anterolaterális oldalán alkalmazni. Ezenkívül a zselatin-hidrogél 24, 25 mikrogömbök formájában lehet, és az AAA körül injektálható. Ha minimálisan invazív módszer alkalmazható, akkor ezt a kezelést kis AAA-ban vagy aneurysma patológiában szenvedő betegeknél lehet alkalmazni, akiknél nagy a műtét kockázata.
Összefoglalva, tanulmányunk egyértelműen bemutatja az EBHG terápiás hatásait a kísérleti AAA progressziójára. Az EBHG-vel végzett kezelés endogén bFGF termelést váltott ki, amely megnövelte a CML-t és a fibroblasztokat, ami megőrzi a rugalmas szálak lebomlását. A szövettani eredményekben megfigyelt javulás a kísérleti AAA progressziójának gátlásához vezetett. Eredményeink a biológiailag lebontható EBHG lehetséges klinikai alkalmazását javasolják az emberi AAA kezelésére, minimálisan invazív módszerrel.
Köszönetet mondunk Dr. Shojiro Matsudának, a Gunze Limited Kutatási és Fejlesztési Központnak az EBHG szállításáért, és a Kaken Pharmaceutical-nak a bFGF szállításáért. Ezt a munkát a Japán Tudományfejlesztési Társaság tudományos kutatási támogatása (JSPS-18591402) támogatta.