Nátrium-karbonátnak, nátrium-karbonátnak, Vichy-sónak vagy nátrium-hidrogén-karbonátnak is nevezik. Ezt a terméket, a NaHCO 3 -ot fehér, kristályos por jellemzi, szagtalan, sós ízű és enyhén lúgos. Oldódik vízben és gyakorlatilag oldhatatlan alkoholban. Száraz levegőben nem változtatható meg, de nedvesben lebomlik.
9 rész hideg vízben oldódik. Ha ezt az oldatot keverjük, a bikarbonát egy része elveszik a CO 2 fejlődése miatt, és ugyanez történik, ha 70 ° C fölé melegítjük. 400 ° C-on melegítve ez a só semleges karbonáttá alakul, hozzávetőleges veszteséggel primitív tömegének 35% -a.
Vízmentes nátrium-karbonátot, közismert néven Solvay-szódát, mosodai szódát, szódasót vagy szódabikarbónát ipari mennyiségben üveg, szappanok, papír, zománcok és egyéb vegyi termékek gyártására, valamint kemény víz tisztítására használják.
A nátrium-hidrogén-karbonátot gyomorsavcsökkentőként használják az orvostudományban. Az ipari szinten előállított hidrogén-karbonát nagy részét a reakció szerint enyhe melegítéssel nátrium-karbonáttá alakítják:
2 NaHCO 3 (s) Na 2 CO 3 (ok) + H 2 O (g) + CO 2 (g)
Biológiai szempontból a CO 2 és a HCO 3 - felelősek az élő szervezetek sav- és báziskészletéért.
üvegtölcsér másikato lombik
Ültető ampulla 15 ml és 100 ml csövek
mosópalack 3 kémcső erlenmeyer lombik buchner tölcsér
100 ml főzőpohár 1 büretta
NaCl AgNO 3 0,5 M
CaCO 3 fenolftalein (FT)
NH 3 15 M (kereskedelmi forgalomban használt) 0,1 N HCl törzsoldat
100 ml 6 M HCl (a hallgatók készítették) metil narancs (NM)
A NaHCO 3 szintézisét ipari szinten Solvay-módszerrel hajtják végre, a reakció telített nátrium-klorid vizes ammónia-oldat és szén-dioxid-oldata között zajlik, amelytől a szilárd nátrium-hidrogén-karbonát elválasztható.
Az alapanyagok a közönséges só (NaCl), a mészkő (főleg CaCO 3-ból áll), mind az olcsó anyagok, mind az ammónia, amely később visszanyerhető az ammónium-klorid-oldatból. A Solvay-folyamat alapján a hidrogén-karbonát szintézisét a következő reakciórendszerrel hajtjuk végre:
A rendszer első részében CO 2 -ot fogunk termelni, ehhez lassan hozzáadjuk a HCl-t a CaCO 3 fölé .
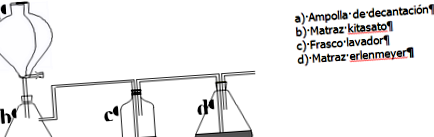
A c palackban mossuk a felszabaduló CO 2 -t a szennyeződések eltávolítása érdekében. A d lombikba érve reagál a konyhasó telített vizes ammóniaoldatával, amelyet főleg az ionok alkotnak: NH 4 +, OH -, Cl - és Na + .
A CO 2 vízzel és ammóniával reagálva NH 4 HCO 3 -ot képez, amely disszociálva monohidrogén-karbonátot eredményez, amely végül telített NaCl-oldatban nátrium-hidrogén-karbonát formájában kicsapódik.
A CO 2 telítettsége és a bikarbonát legjobb kristályosodásához szükséges idő miatt nem tiszta, hanem nátrium-karbonáttal keverik. Ezért a kapott termékben az egyes sók százalékos arányát felmérjük és meghatározzuk.
SZINTÉZISMÓDSZER
A reakciórendszert először összeállítják. 100 ml 6 M sósavat készítünk; Megmérünk 8 g NaCl-ot és 40 g CaCO 3-ot .
A kirakatban a kereskedelmi forgalomban lévő NaCl-t főzőpohárba helyezzük, és 20 ml kereskedelmi ammóniát adunk hozzá. Amikor gyakorlatilag minden feloldódott, az oldatot ráncszűrővel Erlenmeyer-lombikon szűrjük.
A 6 M HCl-t az a) elválasztó fiolába helyezzük. Tegyük a másik b) lombikba a CaCO 3-ot. A vizet a közbenső mosópalackba helyezzük (az üvegcsőnek a folyadék felszíne alatt kell lennie). d) az Erlenmeyer-lombik NaCl telített vizes ammóniaoldatával.
Miután a reakciórendszer összeállt, lassan hozzáadjuk a 6 M HCl-ot a CaCO 3 fölé, és a képződött CO 2 -ot 30 percig buborékoltatjuk az d oldat felett. Egy éjszakán át hagyjuk kristályosodni, és a kapott csapadékot Büchner-tölcséren átszűrjük; 20 ml 50% -os etanollal mossuk, levegőn szárítjuk.
1. Hozza létre azokat a reakciókat, amelyek a gyűjtőrendszer különböző területein zajlanak.
A reakciórendszer c zónájában ellenőrizze a pH-értéket a CO 2 áthaladása előtt és után .
2. Írja le a kapott termék megjelenését
1. Oldja fel a termék egy részét 5 ml vízben. Mérjük meg a kapott oldat pH-ját. Indokolja az említett pH-t a megfelelő ionegyenlet segítségével.
2. Helyezze a kapott termék második részét egy kémcsőbe, és melegítse fel. Jelölje meg a lejátszódó reakciót. Hűtsük le a kémcsövet, és adjunk hozzá 5 ml vizet. Mérjük meg a pH-t, és hasonlítsuk össze az 1. pontban kapottval. Írjuk fel az ionegyenletet, amely igazolja ennek az oldatnak a pH-ját.
3. Tegyen egy harmadik adag terméket egy kémcsőbe, és adjon hozzá 2 ml 3 M sósavat. Milyen gáz szabadul fel? Írja fel a megfelelő kémiai egyenletet!.
4. Ha AgNO 3-at adunk a vizes hidrogén-karbonát-oldathoz, fehér csapadék keletkezik. Ami esedékes lehet?
A NaHCO 3 és a Na 2 CO 3 százalékos arányának meghatározása
- NÁTRIUM-TOSZULFÁT REMÉNY 250 MGML INJEKCIÓS MEGOLDÁS Klinikai ülések
- NÁTRIUM-TOSZULFÁT »Felhasználások, képletek és mellékhatások
- Receptek szódabikarbónával, hogy könnyen zsírégessen
- Nátrium-rendellenességek Klinikai orvostudomány
- Táplálkozási táblázat Hűtött bab, konzerv, hagyományos, csökkentett nátriumtartalmú