Tartalom
Fémspecifikus Calos
célok
- Határozza meg a réz fajhőjét (Cu).
- Kísérletesen ellenőrizze a termodinamika nulla törvényét.
Bevezetés
A különböző anyagoknak eltérő mennyiségű hőre van szükségük ahhoz, hogy hőmérsékletük adott változását előidézzék. Például a víz hőmérsékletének egy hőmérsékleti értékkel történő emeléséhez körülbelül tízszer több hőre van szükség, mint a réz hőmérsékletének emelésével ugyanannyival. Az anyagok ezen viselkedését kvantitatív módon a fajlagos hő jellemzi, amely az anyag hőmérsékletének 1 ° C-os emeléséhez szükséges hőmennyiség. Így a víz fajlagos hője nagyobb, mint a rézé.
Az anyag fajlagos hője minden anyagra jellemző, és annak belső szerkezetétől függ. Amint az a definícióból kitűnik, egy adott anyag fajlagos hőjét úgy lehet meghatározni, hogy ismert mennyiségű hőt juttatunk az anyag adott tömegmennyiségéhez, és megfelelően rögzítjük annak hőmérsékletének változását. A kísérlet célja egy adott anyag fajlagos hőjének meghatározása kalorimetriai módszerekkel.
Elmélet
Az anyag hőmérsékletének változása arányos a hozzáadott vagy kivont hőmennyiséggel, azaz:
Egyenletként írva
Ahol az arányosság állandóját az anyag hőkapacitásának nevezzük.
Az objektum hőmérsékletének megváltoztatásához szükséges hőmennyiség ugyanakkor arányos a tömegével is, ezért célszerű meghatározni a fajlagos hőteljesítménynek (vagy fajhőnek) nevezett mennyiséget
amely az anyag tömegegységének hőkapacitása. Így az (1) egyenlet így írható:
Ahol a fajlagos hő az a hőmennyiség (kalóriákban), amely ahhoz szükséges, hogy 1 gramm anyag hőmérsékletét 1 Celsius-fokkal növelje.
Valójában a kalória a hőegység, amelyet a víz hőmérsékletének 1 ° C-os emeléséhez szükséges hőmennyiségként határozunk meg. Definíció szerint a víz fajlagos hője .
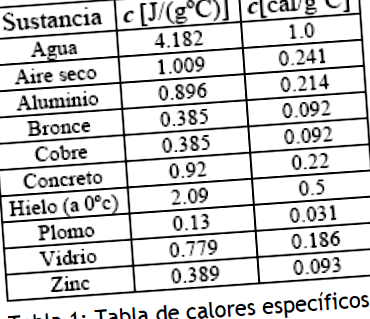
Az alábbi táblázat bemutatja egyes anyagok sajátos hőértékeinek értékeit.
Az anyag fajlagos hőjét kísérletileg meghatározhatjuk a hőmérséklet változásának mérésével, amelyet az anyag bizonyos tömege bizonyos mennyiségű hő leadása esetén mutat. Ez közvetett módon megtehető egy kalorimetriás eljárással, amely a keverési módszer. Különböző hőmérsékletű anyagok különböző hőmérsékleten kerülnek érintkezésbe, a forró anyagok hőt juttatnak a hideg anyagokhoz, amíg az összes anyag el nem éri a közös egyensúlyi hőmérsékletet.
Ha a rendszert olyan szigeteléssel látják el, hogy az energiamegtakarítás miatt nem tud hőt cserélni a környezetével, akkor a forró anyagok által elveszített hőmennyiség megegyezik a hideg anyagokkal.
Ebben a kísérletben forró vizet adunk egy fémrudat tartalmazó kaloriméterhez (hőüveg), majd a kalorimétert néhány másodpercig rázzuk, amíg a rendszer el nem éri a hőegyensúlyt. Vegye figyelembe, hogy a kaloriméter funkciója a rendszer elkülönítése a hőveszteség csökkentése érdekében. Hőteljesítménye azonban ismeretlen, ezért először meg kell mérni.