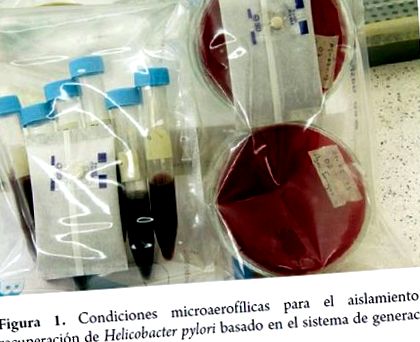
A termesztés mikrobiológiai körülményei Helicobacter pylori
Martín Alonso Bayona Rojas, Bact., Esp., Msc. (1)
(1) Az Orvostudományi Kar professzora, az orvosbiológiai kutatások és alkalmazott genetika csoportja (GIBGA). Alkalmazott és Környezettudományi Egyetem U.D.C.A. Bogota Kolumbia. e-mail: [email protected]
Fogadás dátuma: 09-17-12 Elfogadott dátum: 04-16-13
A Helicobacter pylori Nagy jelentőségű a növekedésének jellemzőinek tanulmányozása, valamint hozzájárulni a klasszikus és molekuláris epidemiológia, a genetikai sokféleség és az antibiotikumokra való hajlam ismeretéhez. Ennek a mikroorganizmusnak a jelenléte és jelentősége kórokozóként világszerte arra kényszerít bennünket, hogy fontoljunk meg és javasoljunk hatékony alternatívákat a mikrobiológiai laboratóriumok rutinszerű elkülönítésére és azonosítására. Ennek az áttekintésnek az volt a célja, hogy leírja az irodalmat a mikroorganizmus laboratóriumban történő termesztéséhez szükséges körülményekről.
Kulcsszavak
Helicobacter pylori, mikrobiológia, izoláció, mikrobiális tenyészet.
HÁTTÉR
Kiszámítják, hogy H. pylori a világ népességének 50–75% -át megfertőzi. A mikroorganizmus által fertőzött minden 10 ember közül csak egy szenved betegségben, kilenc pedig soha nem fejlődik ki. A fertőzés etiológiailag a gyomor vagy a nyombél peptikus fekélyeinek megjelenésével és egy speciális típusú gyomor limfóma kialakulásával, az úgynevezett maltomával társul; ugyanígy részt vesz a gyomorrák kialakulásának etiológiai multikauzális láncolatában (1). Valójában az Egészségügyi Világszervezet ezt a kórokozót az ember biológiai rákkeltőjeként osztályozta (1. kategória), ahol a fertőzések előfordulási gyakorisága a fejlődő országokban gyermekkorban fordul elő, és úgy tűnik, hogy összefügg a gazdasági feltételekkel. És kedvezőtlen higiénés-egészségügyi ( 3). Úgy tűnik, hogy a különböző törzsek összefüggésben vannak virulenciájuk sokféleségével és a tényezők kölcsönhatásával, többek között az etnikai származás, a rossz táplálkozás, a túlzsúfoltság, a földrajz és az életkor között (4).
Ez a cikk a növényorientált mikrobiológiai szempontok és az abban rejlő tényezők áttekintését mutatja be. A bibliográfiai kereséshez a következő adatbázisokat tárták fel: Medline, Proquest, Embase, Jstore, Pubmed, Hinary, Springer, Nature, Science online és Oxford Journal, valamint olyan magánfolyóiratokban, mint a Plos, a Nas és az Imbiomed. A kifejezéseket kombinálták: Helicobacter és karbantartás, kiegészítők Helicobacter, Laboratóriumi karbantartás, szilárd táptalajon történő tenyésztés, érzékenység az antibiotikumokra.
Kolumbiában az Universidad del Valle által a kolumbiai Tudományos és Technológiai Fejlesztési Intézettel finanszírozott kutatás során 69,1% -os fertőzés előfordulásáról számoltak be. H. pylori Kolumbia 16 osztályának regionális kórházaiban az emésztőrendszer felső endoszkópiájából vett biopsziás mintákban. A korábbi évtizedekben a savas peptikus betegség és a gyomor adenokarcinóma okainak kutatása elsősorban az étrendi tényezőkre összpontosított, de H. pylori mint gyakori gyomor kórokozó megváltoztatta az etiológiai fogalmakat ezekről és más gastroduodenalis betegségekről (5).
Tanulmányozása H. pylori Hazánkban az előző évtized végén kezdődött, és kevés jelentés található laboratóriumokról, akik tapasztalták az izolálásához és termesztéséhez szükséges mikrobiológiai készségeket (6).
MIKROBIOLÓGIAI JELLEMZŐK
A nemzetség tagjai Helicobacter 1989-ben írták le, kolonizálják az emberek és egyes állatfajok gyomrát és belét, ez egy ívelt, mikroaerofil Gram-negatív bacillus, külső membránja és 4-8 poláris flagellája van, amelyet lipidszerkezet-burkolat véd. Az általa termelt enzimek: ureaz, kataláz és citokróm-oxidáz. Az urea az egyik baktérium virulencia tényezője H. pylori amely a karbamidot NH3-vá és vízzé alakítja, ezáltal lúgosítva a környező savas környezetet; egyéb tényezők a lipázban, adhezinekben, katalázban, a vérlemezkéket aktiváló faktorban, a citotoxinnal társított Cag A gén fehérjéjében, B képében (amely citokineket indukál) és a vakuolizáló citozin Vac A-ban (3, 7).
A tenyésztéshez a mintákat a gyomor nyálkahártyájából, és a fog lepedékéből, a végbélből, a hólyagból és a nyelőcsőből vett extragasztrikus mintákat veszik; a kolóniák kialakulásához szükséges idő 4-7 nap, a következő körülmények között: 5-10% 02; 5-10% C02; 80-90% N2, 95% páratartalom és 35-37 ° C hőmérséklet. Általában összetett közegben termesztik vérrel, szérummal és antibiotikumokkal (7).
A MINTAVÉTEL FELTÉTELEI
A krónikus gyomorhurutban szenvedő betegeknél a biopsziák felvételének ajánlott protokollja a Sydney-rendszer által javasolt. meg kell említeni, hogy H. pylori Főleg a gyomor antrális részében található meg, kivéve azokat az egyéneket, akiket PPI-k és anti-H2 antihisztaminok kezeltek, ahol nagyobb sűrűség található a testben. 5 biopsziát kell venni az alábbiak szerint: két antrális mintát a nagyobb és a legkisebb görbületből 2–3 centiméterre a pylorus közelében, két testet a testből a nagyobb és a legkisebb görbületből, 8 cm-re a kardia távolságától, és egy mintát a incisura angularis (8). E protokoll alkalmazásával a baktériumok gyakorlatilag minden fertőzött egyedben kimutathatók (9). A biopszia felvétele gyakorlatilag fájdalommentes folyamat a páciens számára, de ez egy olyan eljárás, amelyet szakértő gasztroenterológusnak kell elvégeznie a bevett orvosi etikai protokollok betartásával. Nem ajánlott az eljárást vérző fekélyű betegeknél végrehajtani, mivel ez vérzési veszélyt jelenthet. Valamennyi tanulmányt az Etikai Bizottságnak jóvá kell hagynia, és egyértelmű tájékoztatáson alapuló beleegyezéssel kell rendelkeznie.
Más gyomormintákat, például gyomornedvet használtak, amelyeket a húrpróba és a hányástól való izolálás során nyertek, és más eredményeket hoztak. H. pylori Alkalmanként tenyésztették extragasztrikus mintákból is, mint pl. Fog plakk, nyelőcső, végbél és húgyhólyag.
Szem előtt tartandó szempontok: ha a beteg antibiotikumot kapott, az utolsó adag után legalább négy hetet kell várni, hogy kielégítő eredményeket érjen el a tenyésztés szempontjából. A csipeszeket, amelyekkel a biopsziákat végzik, megfelelően fertőtleníteni kell a betegek közötti szennyeződés elkerülése érdekében; Ha a fertőtlenítés túl erős, ez befolyásolhatja a baktériumok életképességét.
A biopsziás mintákat kis mennyiségű fiziológiás sóoldattal meg kell őrölni vagy porítani, mielőtt a táptalajra felviszik. A homogén mintát azonnal a táptalaj felületére kell helyezni: fogantyúval kell venni, majd elkülönítésre szolgáló szórási módszerrel el kell teríteni a felületen (8, 9).
A kapott mintákat gyorsan fel kell dolgozni, mivel a mikroorganizmus nagyon érzékeny a környezetre. A biopsziás mintákat (amelyeket az antrumból és a testből vettek) steril csavaros kupakba kell tenni, 0,5 ml sóoldattal, és legfeljebb 6 órán át ott maradhatnak. Ha késés várható, olyan szállítóeszközt kell használni, mint a Stuart táptalaj, és 4-8 ° C hőmérsékleten kell tartani, legfeljebb 24 órán át a feldolgozás előtt, majd homogenizálni és két példányban elvetni különböző táptalajokba, beleértve a húslevest és a táptalajt. agar Brucella, A BHI, a Mueller Hinton, a Columbia agar és a szójabab triptikáza általában marha magzati szérummal, vörösvértest-lizátummal, élesztő-kivonattal, peptonnal és cianobaktérium-kivonattal egészül ki. Vért (ló, bárány, nyúl) általában 7 és 10% között adnak, és a táptalajba adott antibiotikumok között szerepelnek: vankomicin, szulfametoxazol, trimetoprim, cefsulodin és polimixin B. A mintákat triptikáz szójalevesben vagy BHI-ben tárolhatjuk 20% glicerinnel, amelyeket -80 ° C-on fagyasztóban vagy folyékony N2-ben (10-12) tárolnak.
A termény hasznossága és fontossága a H. pylori abban rejlik, hogy megismerhetjük növekedési jellemzőit, genetikai sokféleségét, epidemiológiáját és a kezelésben alkalmazott antibiotikumokkal szembeni bakteriális rezisztencia meghatározásának lehetőségét (7, 13).
Tersterman és munkatársai (2001) meghatározott szubsztrátokkal rendelkező táptalaj (Hams F-12) alkalmazását írják le, amelyet emlős sejtek tenyésztésére használnak. Az elkülönítéshez H. pylori Olyan módosításokat hajtottak végre, amelyek abból álltak, hogy B-ciklodextrinnel, koleszterinnel és szarvasmarha magzati szérummal egészítették ki vér hozzáadása nélkül, ami ezt a táptalajt drágítja. Hagyományos véragart használtunk, biopsziás magvakat és referencia törzseket H. pylori, növekedés elérése az esetek 100% -ában (14).
Joo és mtsai (2010), amikor vékony rétegű folyékony tenyésztési rendszert hoztak létre a H. pylori húsleves hozzáadásával Brucella A 90 mm átmérőjű Petri-csészékben, amelyekhez lószérumot, élesztő kivonatot és dimetil-béta-ciklodextrint adtak, 3,3 órás generációs időt értek el, ezt a mikroorganizmust 28 órán át exponenciálisan növelték (15.
Stevenson és munkatársai (2000) javasolnak egy alternatív táptalajt, amelynek alapkomponense Columbia agarból és antibiotikumok keverékéből áll, amelyek gátolják a kísérő mikrobiális terhelést, mint például vankomicin, amfotericin B, trimetoprim és cefsulodin. Ezenkívül lóvért, húskivonatot, agar agart és kukoricakeményítőt tartalmaz (16).
Amikor a pylorus antrum és a gyomor fundusának vetését Columbia agarra 7% defibrinált bárányvérrel és szelektív DENT kiegészítõvel (vankomicin, trimetoprim, amfotericin B és cefsulodin) adtuk, magas specifitást (100%) kaptunk, figyelembe véve a bakteriológiai tenyészetet arany bizonyítékként (17).
Sikeres termesztése Helicobacter friss bárány- vagy lóvér használatát igényli a használt agarokban. A kereskedelemben előállított táptalaj működhet, de ezek frissességét nehéz ellenőrizni, és gyakran túl idősek vagy túl szárazak, valamint hiányozhatnak a megfelelő szelektív antibiotikumok. Az agarok elkészítése után nem szabad azonnal felhasználni őket, zárt műanyag zacskókban kell tartani 4 ° C-on, legfeljebb 2-3 hétig (7). A fentieket megerősítették kutatásaink, kiemelve, hogy a lóvérrel (8%) kiegészített Brucela agar alkalmazása jobb helyreállítást kínál a bárányvérhez képest (8%), és hogy megőrzését 4 ° C/év maximális időtartama 20 nap.
Yepes és mtsai (2008) által végzett tanulmányban, amelyben a H. pylori a Hospital Universitario San Ignacio (HUSI) gasztroenterológiai szolgálatának betegeinél a kapott mintákat először csavaros kupakkal ellátott steril csőben szállították és -70 ° C-on fagyasztották le legfeljebb 3 hétig. Ezt követően a mintát megolvasztjuk és agaron tenyésztjük. Brucella 5% bárányvérrel kiegészítve és 5 napig inkubáltuk nedves mikroaerofil táptalajban, 37 ° C-on (18).
A cianobaktériumok kivonatával (MH-CE) kiegészített Mueller Hinton táptalajból álló alternatív transzportközeg értékelésekor és a tápközeggel összehasonlítva, a Mueller Hinton húsleves magzati borjúszérummal (MH-FCS) kiegészítve, azt az eredményt kaptuk, hogy 48 óra múlva helyreállt szobahőmérsékleten az MH-CE-ben magasabb volt (p kisebb vagy egyenlő, mint 0,005), mint az MH-FCS-ben. Az MH-CE táptalaj egyszerű, olcsó, és felhasználható az életképességének megőrzésére H. pylori és gyógyulása biopsziából (19).
Trespalacios és mtsai (2010) izolálták és azonosították H. pylori gyomorbiopsziákból, amelyeket 1% aktív szén oldatban maceráltunk, így homogén oldatot kaptunk. Ezt követően a módosított Wilkins-Chalgren táptalajba vetettük, kiegészítve izovitalexszel és antibiotikumokkal, amelyeket anaerobiosisban inkubáltunk 37 ° C-on 4-15 napig, 79 izolátumot kapva és 80% -os gyógyulást jelentve (20).
Quiroga és mtsai (2005), amikor aszeptikus körülmények között macerált és táptalajban tenyésztett gastroduodenalis betegségekben szenvedő betegek biopsziás mintáit tenyésztették H. pylori (Lab M), 8% lószérummal, 1% izovitalexszel és a Campylobacter (Merck) jó eredményekről számolt be a H. pylori (huszonegy).
Az in vitro növekedése H. pylori táptalajt igényel, például húslevest vagy agart Brucella vitaminokkal és lószérummal vagy ciklodextrinekkel kiegészítve. A folyékony közegek általában lassú növekedést mutatnak. Ha a szérumot vagy a ciklodextrineket egy kereskedelemben kapható koleszterin-oldattal helyettesítjük, az optimális növekedés H. pylori alternatívát jelent a klinikai mintákból történő helyreállításhoz (22).
Majalca és mtsai (2001) 2% liofilizált hemoglobinnal, agarral értékelték a GC alap táptalajt (gél, csokoládé) Campylobacter, Casman agar, Columbia agar, agyszív infúziós agar, Brucella, Mueller Hinton agar és triptikáz szója agar, mindegyikhez 7-10% ló- vagy bárányvért adunk, antimikrobiális szerekkel kiegészítve és NAD (nikotinamid-adenin) vagy anélkül 15 ug/ml koncentrációban. A mikroaerofil környezetet CO2-generáló burkolatokkal és három Alkaseltzer-tabletta 10 ml vízben történő felhasználásával, parafilmmel lezárt palackban, gyertyával vagy anélkül végeztük el. A törzseket -70 ° C-on húsleves alkalmazásával tároltuk Brucella 10% lószérum, 25% glicerin és lóvér, valamint húsleves hozzáadása Brucella 10% szarvasmarha-magzati szérum és 30% glicerin hozzáadása. A kapott eredmények közül a következők emelkednek ki: a három Alkaseltzer-tablettával elért optimális mikroaerofil környezet. Az a táptalaj, amely a legjobb eredményt mutatta a H. pylori Casman agarnak felel meg 7% lóvérrel 5-7 napig, a legjobb tartósító táptalaj pedig húslevesnek felel meg Brucella 2% szarvasmarha-magzati szérummal (23).
A táptalajok érzékenysége a különböző változókhoz viszonyítva változik: gyűjtés, szállítás, a minta tárolása, táptalaj és inkubációs körülmények. Navarro és mtsai (2007) három táptalaj ökomometriai módszerét értékelték: triptikáz szója agar, BHI agar és agar Brucella, amelyhez 5% bárányvért adtak. A három média ellenálló képessége a H. pylori alacsony volt, és korrelált egy 2,5 alatti abszolút növekedési indexszel (ICA), jelezve, hogy mindegyikük nem rendelkezik jó helyreállítási képességgel, valószínűleg az alacsony vérkoncentráció és az olyan tápanyagok hiánya miatt, mint az izovitalex (24).
A növekedés H. pylori Szérum hiányában még mindig nehéz, és egyes táplálkozási igényeket csak részben határoztak meg, mivel az aminosavak, a fémek, a vas nátrium-kloridja, a cink és a magnézium kritikus jelentőségű volt a növekedés szempontjából; rézre nem volt szükség. Ezek az adatok azt jelzik H. pylori és mások Helicobacter spp nem annyira igényesek, mint azt korábban gondolták. Az adatok arra is utalnak, hogy a leírt kémiailag meghatározott táptalajok széles skálájának növekedését generálhatják Helicobacter spp, lehetővé téve fiziológiájának és a gazdasejtekkel való kölcsönhatásainak részletesebb jellemzését (25).
Mcnulty és mtsai (2002) a Wilkins-Chalgren táptalaj alkalmazását javasolják-Brucella, visszaszerzésében H. pylori a gyomorbiopsziák szelektív táptalajként való katalógusa.
Miendje és mtsai (2010), amikor három szelektív táptalajt (PYL-bioMérieux, Franciaország; Helicobacter agar-Beckton Dickinson, E.U és Brugman Helicobacter agar) értékeltek a H. pylori a gyomorbiopsziák alapján nem találtak szignifikáns különbséget a telepek számában és a gyógyulási arányban. Megfigyelték a tipikus telepek megjelenését, amelyeket Gram festéssel és biokémiai tesztekkel azonosítottak, mint például kataláz, oxidáz és ureaz (27).
ANTIBIOGRAM
Az érzékenység felmérése H. pylori Az antibiotikumokkal összehasonlítva a Klinikai és Laboratóriumi Szabványügyi Intézet (CLSI) által jóváhagyott referencia-módszer megegyezik az antibiotikum agarban történő hígításának módszerével (28).
Másrészt a brit antimikrobiális kemoterápiás társaság javasolja az E-tesztet (epsilométeres módszer), amely jó összefüggést mutat a referencia-módszerrel (10).
Az érzékenységi teszthez 5% bárányvérrel kiegészített Muller Hinton agart használnak. Az inokulumot 0,85% sóoldatban állítjuk elő, összehasonlítva a MacFarland skála 2. számú csövével (1x10 7 - 1x108 CFU/ml). Ennek az oltóanyagnak a megszerzéséhez a törzset 72 órás szubkultúrából kell venni véragaron; ugyanígy, alternatívaként a H. pylori 2-3 napos inkubálás után készítsen szuszpenziót húslevesben Brucella a Macfarland-skálához igazítva (1 x 108 CFU/ml), amelyeket 10% lószérummal és 2% izovitalexszel kiegészített Mueller Hinton agarral lemezekre oltunk (20).
Figyelembe véve, hogy az agar-hígítási módszer nem rutinszerűen alkalmazható, az E-teszt költséges, és hogy a metronidazol esetében is észlelhetők eltérések, McNulty 2002-ben áttekintette azokat a vizsgálatokat, amelyekben a lemezzel történő diffúziót ajánlotta:
Korong koncentráció és vágási pontok: metronidazol esetében 5 µg-os lemez használata ajánlott, és ellenállónak tekinthető, ha a halo 21 mm. Közepes érzékenységű törzsek esetén MIC-meghatározási módszer ajánlott. Klaritromicin esetében 2 µg-os lemez használata rezisztensnek tekinthető, ha nincs gátló halo. 15 ug klaritromicin lemez is használható és rezisztensnek tekinthető, ha a halogénatom van