- Tárgyak
- Összegzés
- Bevezetés
- Eredmények
- A glikopattern megváltozása a szérumokban az ASD és a TD miatt
- MBG azonosító
- Az MBG-k gén ontológiai elemzése
- KEGG útvonal és fehérje kölcsönhatás hálózat elemzése
- MBG szekvencia motívum preferencia
- Az MBG expressziója és szialoglikozilezése egyes szérummintákban
- Vita
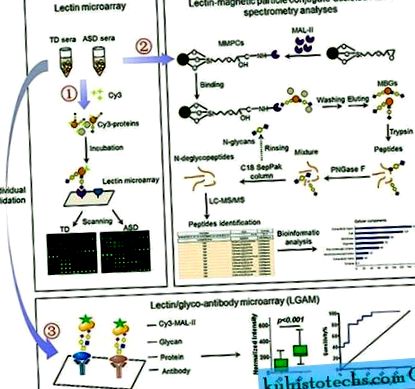
- Anyagok és metódusok
- Tanulmány jóváhagyása
- Tárgyak
- Mintagyűjtés és előkészítés
- Lektin mikrorakók és adatelemzés
- Szérum mikrorajzolás és adatelemzés
- MBG-k izolálása és emésztése
- LC-MS/MS elemzés
- Címke nélküli relatív mennyiségi meghatározás spektrális index számítással
- Adatbányászat és bioinformatika
- Lektin/gliko-antitest mikrorajzok és adatelemzés
- további információ
- Kiegészítő információk
- PDF fájlok
- Kiegészítő információk
- Excel fájlok
- Kiegészítő táblázatok
- Hozzászólások
Tárgyak
- Autizmus spektrum rendellenességek
- Biomarkerek
- Glükomika
Összegzés
A proteomikai eszközök lehetővé teszik a technológia által vezérelt, nagy léptékű automatizált vizsgálati módot, amely lehetőséget ad arra, hogy egy adott testfolyadékban meghatározzuk a teljes proteomot, a molekulák jelöltjével kapcsolatos előzetes feltételezések nélkül 12. Ez alapján összesen öt peptidkomponens, amely megfelel négy ismert fehérjének [Apolipoprotein (apo) B-100, H-komplement faktorral kapcsolatos fehérje (FHR1), C1q-kiegészítő és Fibronectin 1 (FN1)] magasabbnak bizonyult az autizmus esetében a kontrollokhoz képest 13. Három potenciális biomarker csúcs azt mutatta, hogy a m/z arány körülbelül 4,40, 5,15 és 10,38 kDa volt, és szignifikánsan megkülönböztette az ASD mintát a kontroll csoporttól, amikor a teljes fehérjéket és a nem peptideket triptikus emésztés után elemeztük 14 .
Teljes méretű kép
Eredmények
A glikopternának megváltozása a szérumokban az ASD és a TD miatt
A lektin mikroszkóp kialakítását és a szérum glikoproteinek ASC és TD csoportokra definiált glikoproteinjeinek eredményeit a 2A, B. ábrán mutatjuk be. Az eredeti adatokat hierarchikus klaszterelemzés céljából importáltuk az EXPANDER 6.0 programba (2. ábra C) . A két csoport 37 lektinjének normalizált fluoreszcencia intenzitását (NFI) és cukorkötési specifitását az S1. Táblázat foglalja össze. A differenciálanalízis eredményeként öt lektin mutatott szignifikáns különbségeket az ASD és a TD csoport között. A MAL-II (Siaα2-3 Gal/GalNAc) és a MAL-I (Siaα2-3Galβ-1, 4GlcNAc és Galβ-1, 4GlcNAc) mutatta a legjelentősebben megnövekedett NFI-ket (szeres változás = 3,33 és 2,20, p
( NAK NEK ) A lektin mikrorajz tervezése. ( B ) TD és ASD Cy3-jelölt szérumfehérjék képei lektin-mikroszórákhoz kötve. A fluoreszkáló képeket 70% -os fényszorzóval ellátott csővel és 100% -os lézeres teljesítmény-beállításokkal szkennelték egy Genepix 40 00B konfokális szkennerrel. A tárgylemez egy részét három replikált lektin tömb jelzi. A lektinek jelentős különbségeket mutatnak, fehér keretekkel jelölve. ( C ) NFI hierarchikus klaszterelemzés a 37 TD-1 lektinhez
5. A minták oszlopokban, a lektinek sorokban vannak felsorolva. Az egyes négyzetek színe és intenzitása a kifejezés többi szintjéhez viszonyított kifejezési szintet jelez. Piros, magas; Nézz le; fekete, közepes. A sárga és a kék keret magasabb és alacsonyabb lektinkötési intenzitást jelzett az ASD-vel szemben a TD-szérumokban. ( D ) Az NFI differenciális elemzése öt TD-1 lektin esetében
( A, B ) A peptidek és azok megfelelő glikoproteinek azonosítása TD és ASD szérumokban LC-MS/MS segítségével. ( C ) Az UniProtKB/Swiss-Prot adatbázisból ismert N-glikoproteinek (NY) és O-glikoproteinek (OY), valamint a potenciális N-glikozilációs (NP) és potenciális O-glikozilációs (OP) helyekkel rendelkező előrejelzett glikoproteinek aránya) ( D ) Az azonosított (vörös csillaggal jelölt) GBM KEGG-útvonalának elemzése a komplement- és koagulációs kaszkádokban 60. Piros nyíl, az MBG felfelé történő szabályozása; zöld nyíl, alacsony GBM-szabályozás az ASD-ben. Az azonosított GBM-ek (vörös gömb) fehérje-interakciós hálózatának elemzése, amelyek a szabályozásban felfelé (piros nyíl) vagy lefelé (kék nyíl) voltak szabályozva ( ÉS ) és a negatív szabályozás ( F ) az ASD szérumokban az ingerreakció folyamatairól. ( G ) Lehetséges N-glikozilezési és O-glikozilezési motívumok az aszparagin és szerin maradványok körül az α2-3-hez kapcsolt szialilezett glikopeptid doménhez. A WebLogo relatív frekvencia diagramokat generált a szignifikáns szekvencia motívumhoz. A maradványok magassága nagyjából arányos binomiális valószínűségükkel.
Teljes méretű kép
Az MBG-k gén ontológiai elemzése
KEGG útvonal és fehérje kölcsönhatás hálózat elemzése
Összesen 243 azonosított MBG-ból 184-et jegyeztek fel a DAVID Bioinformatics Resources (6.7 verzió). Ezeket a GBM-eket 6 KEGG útvonalra térképeztük fel, amelyek számolási küszöbértéke ≥5 volt, és P30 értékkel (S1 kiegészítő ábra). Összehasonlítottuk a környező aszparagin-aminosavak helyzetspecifikus aminosav-frekvenciáit (mindkét aminosavban 13 aminosavat), és az [AVH] [KR] xNxxNxSxxxY motívumot (ahol "x" bármilyen maradékot jelöl, az [AVH] és [KR] jelent Számos aminosavmaradékot azonosítottak, amelyek jelenhetnek meg a pozícióban, és a matrica egy lehetséges glikozitot jelez), mint lehetséges aszparagin körüli N-glikozilezési motívum (3G ábra). Érdekes módon az xxxxxxQSDxxYK és xxxxxxHGSxSGx motívumok jelentősen felülreprezentáltak (a növekedés növekedése = 81,62 és 67,07) a GBM-adatokban (3G ábra), amelyek O-kapcsolt glikozilációs motívumokat reprezentálhatnak az α2-3-hoz csatolt szialilált glikopeptid domén szerinmaradványai körül. Az MBG-ben lévő O-glükozitok további megerősítéséhez azonban még mindig sokkal részletesebb vizsgálatokra van szükség.
Az MBG expressziója és szialoglikozilezése egyes szérummintákban
Western-blot-vizsgálatot végeztek a C8B, a szerotranszferrin (TF), a C1QA és az APOD expressziójának igazolására az egyes szérummintákban. Ennek eredményeként a C8B és a TF expressziója nőtt és a C1Q expresszió csökkent négy tesztelt ASD mintában négy TD mintához képest, amelyek összhangban voltak az MS eredményekkel (4A. Ábra). Az APOD expressziója azonban nem különbözött szignifikánsan a TD és az ASD minták között (4A. Ábra). Az LGAM-okat a C8B, TF, C1QA és APOD α2-3-kapcsolt szialoglikozilezésének kimutatására tervezték 15 egyedi TD és 15 ASD szérummintában (4B. Ábra). Ennek eredményeként két csoport között nem találtak szignifikáns különbséget a C8B, TF és C1QA szialoglikozilációban. Az APOD α2-3 siolokozilációja azonban szignifikánsan megnőtt az ASD mintákban a TD mintákhoz képest (p = 0,004) (4C. Ábra). A ROC-görbe elemzéséből kiderült, hogy az α2-3 szialoglikozilezett APOD szérumszintje 0,88 AUC-t eredményezett, 86,7% -os specificitással és 80,6% -os érzékenységgel különböztette meg az ASD-t a TD-től) (4D. Ábra).
( NAK NEK ) A C8B, TF, C1QA és APOD expressziójának Western blot elemzése négy TD és négy ASD szérummintában. ( B ) Az LGAM-okból származó képek beolvasása TD és ASD szérumokra. ( C ) Box-plot elemzés a C8B, TF, C1QA és APOD kötődési intenzitásának 30 szérum TD és ASD esetére LGAM-mal. A hibasávok az átlag 95% -os konfidencia intervallumát képviselik. A csoportok közötti statisztikailag szignifikáns különbségeket a P értékek ( D ) Az α2-3 szialoglikozilezett APOD ROC görbe elemzése az ASD minták megkülönböztetésére a TD mintákról.
Teljes méretű kép
Vita
Jellemzően a sziálsav a nyákok, glikoproteinek és glikolipidek oligoszacharidláncainak egyik komponenseként található, amelyek az N- vagy O-glikánok nem redukáló terminális pozícióit foglalják el. A sziálsavszint a szérumban májbetegségekkel 46, reumás betegségekkel 47 és 2-es típusú cukorbetegséggel társul. Ebben a vizsgálatban a Western blot-analízis az egyes ASD és TD szérum mintákban validálta a C8B, TF és C1QA expresszió változását, de nem az APOD expressziót (4A. Ábra). Az LGAM-ok az APOD α2-3 szialoglikozilációjának szignifikánsan megnövekedett expresszióját tárták fel az egyes ASD szérummintákban, ami nagyban magyarázta az APOD fehérje expressziójának különbségét az ASD és a TD szérumok között, és hangsúlyozták, hogy mind az MBG, mind pedig az α2-3 szialoglikozilációjuk összefüggésben van az ASD-vel. A ROC görbe elemzése azt mutatta, hogy a szialoglikozilezett APOD képes érzékenyen és specifikusan megkülönböztetni az ASD-s gyermekeket a TD-től, mint jelölt biomarkerekről (AUC = 0,88), és jelezte a szérumokban található glikoproteinek glikozilációjának változásának fontosságát és szükségességét a diagnózis érdekében az ASD.
Összefoglalva, a szialozil-T a2-3 antigének expressziója szignifikánsan megnövekedett az ASD-vel szemben a TD szérumokban. A TD és ASD szérumokból összesen 194, illetve 217 MBG-t azonosítottak, amelyek közül 74 fehérjét speciálisan azonosítottak vagy feljebb szabályoztak az ASD szérumokban. A bioinformatikai elemzés feltárta, hogy az abnormális komplement kaszkád és az ingerre adott válasz aberrált sejtszabályozása újszerű alkotók vagy az ASD markerei lehetnek, új információkat szolgáltatva az ASD patogenezisének jövőbeli mélyreható kutatásához. Ennél is fontosabb, hogy az LGAM-ok szignifikánsan magasabb APOD α2-3 szialoglikoziláció expressziót mutattak ki az egyes ASD szérum mintákban, amelyek potenciális biomarkerként szolgálhatnak az ASD diagnózisában.
Anyagok és metódusok
Tanulmány jóváhagyása
Az összes humán patológiai minta gyűjtését és felhasználását az itt bemutatott kutatáshoz az Északnyugati Egyetem Etikai Bizottsága, a Shaanxi Tartományi Népi Kórház és a Negyedik Katonai Orvostudományi Egyetem (Hszian, Kína) hagyta jóvá. Tájékozott írásos beleegyezést kaptak a résztvevők az összes nyáluk és szérumuk összegyűjtésére. Ez a tanulmány a Helsinki Nyilatkozat etikai irányelveinek megfelelően készült.
Tárgyak
Teljes méretű asztal
Ennek a kutatásnak az engedélyét az Etikai Bizottság és a Hszian Jiaotong Egyetem (Kína, Hszian) Humán Kutatási Felülvizsgálati Bizottsága szerezte. A vizsgálatba bevont résztvevők minden szülője írásos beleegyezését adta. Minden kísérletet a jóváhagyott irányelveknek megfelelően hajtottunk végre.
Mintagyűjtés és előkészítés
Az összes vérmintát gyermekápoló gyűjtötte és vénás vért gyűjtöttek. A vért szobahőmérsékleten hagytuk alvadni 25 percig. Az alvadékot ezután 1500 g-vel 10 percig, hűtött centrifugában centrifugáljuk. A kapott felülúszót azonnal átvisszük egy tiszta polipropilén csőbe, amelyhez EDTA-mentes inhibitor koktélt (Halt proteáz inhibitor; Thermo Scientific Pierce Protein Research Products, Rockford, IL, USA) adunk, 10 μl/ml szérumkoncentráció mellett. Az előállított szérumot kis részletekben alikvotáljuk, és azonnal szárazjégre fagyasztjuk, és -80 ° C-on tároljuk. Az alanyok közötti különbségek normalizálása és az egyéni variációk tolerálása érdekében 50 μl 50 szérummintát gyűjtöttünk a TD, illetve az ASD csoportból. lektin mikrorangerek és LC-MS/MS detektálás. Mindegyik csoportból a másik 15 mintát külön-külön tartottuk fenn a későbbi validálás céljából.
Lektin mikrorakók és adatelemzés
A lektin mikroray-t előállítottuk és Cy3 fluoreszcens festékkel jelölt szérumfehérjékkel (GE Healthcare) inkubáltuk korábbi 50, 51, 52, 53 protokollunk szerint, amelyet részletesen a Kiegészítő anyagok és módszerek ismertetnek. 50 TD és 50 ASD szérum mintát alkalmaztunk a lektin mikroarray kimutatására. Minden mintából húsz mikrolitert (20 μl) és egy mintából 10 mintát készítettünk a TD-1 alcsoportok kialakításához.
5. A megszerzett képeket 532 nm-en elemeztük Cy3 kimutatásra Genepix 3.0 szoftverrel. Az átlagos hátteret kivonjuk, és az átlagos háttér ± 2 szórásnál (SD) kisebb értékeket távolítunk el minden adatpontról. Az egyes lektinek effektív adatpontjának mediánját globálisan normalizáltuk az egyes lektinekre vonatkozó blokkokban az összes effektív adatpont mediánjának összegére. Mindegyik mintát következetesen három ismételt tárgylemezzel figyeltük meg, és 9 ismételt blokk mindegyik lektinjének normalizált mediánját átlagoltuk, és meghatároztuk az SD-t. A TD és ASD csoportok normalizált adatait a következő kritériumok alapján hasonlítottuk össze: ≥1,5 vagy ≤0,67-szeres változás az up- vagy down-regulációt jelezte. A két tetszőleges adatkészlet közötti különbségeket páros tanuló t-tesztjével teszteltük az SPSS Statistics 19 segítségével. Az eredeti adatokat az Expander 6.0 (//acgt.cs.tau.ac.il/expander/) alkalmazásával tovább elemeztük, hogy hierarchikus csoportosítást végezzünk. elemzés.
Szérum mikrorajzolás és adatelemzés
Szérum mikroray-t állítottunk elő 30 egyenként 15 TD és 15 ASD gyermek szérummintájának felhasználásával. A Cy3-jelölt MAL-II-t alkalmaztuk a specifikus cukorszerkezet kimutatására a minimális szérummintákban, amelyek a tárgylemezekre immobilizálódtak az 51-es nyál mikroarray gyártási protokollja szerint, némi módosítással. Részletes információkat a Kiegészítő anyagok és módszerek tartalmaznak.
MBG-k izolálása és emésztése
A MAL-II mágneses részecske konjugátumokat (MMPC) az 54., 55. leírás szerint állítottuk elő. Két milligramm (
30 μl-t, Bradford-reagenssel mérve) egyesített TD és ASD szérumokból származó fehérjét inkubáltunk az MMPC-kkel 54, 55. A kapott glikoproteineket (kb. 150 μg) tripszinnel és PNGáz F-gyel emésztettük, az előzőekben 54, 55, 56 leírtak szerint. Részletes információkat a Kiegészítő anyagok és módszerek tartalmaznak.
LC-MS/MS elemzés
Az MS elemzését LTQ Orbitrap XL tömegspektrométerrel (Thermo Scientific) végeztük. Az ebben a kísérletben használt részletes paramétereket a Kiegészítő anyagok és módszerek tartalmazzák. A nyers adatokat a Proteome Discoverer (1.4.0.288 verzió, Thermo Fischer Scientific) segítségével dolgoztuk fel. Az MS/MS spektrumokat SEQUEST motorral kerestük az UniProt humán teljes proteom adatbázis és a szennyező adatbázis (Release 2013_06, 88913 Protein szekvenciák) alapján. A keresést a következő paraméterekkel hajtották végre: prekurzor tömegtűrése 20 ppm; MS/MS tömegtűrés 0,6 Da; két elmulasztott hasítás a triptikus peptidek esetében; változó módosítású oxidáció (M), metiltio (C), peptid spektrális egyezések (PSM) hitelesítését célzott csalik adatbázis kereséssel (FDR ≤ 0,01).
Címke nélküli relatív mennyiségi meghatározás spektrális index számítással
A peptid-azonosítás után a ProteinExtractor in ProteinScape-hez hasonló algoritmust alkalmaztunk, amely adott minimális peptid-pontszámot (minPepScore) és minimális fehérjére jutó peptidszámot (minNrPeps) használ, az 57-es leírás szerint. A felsorolt fehérjék közül minden peptidspektrum-egyezést (PSM) kivontunk. A spektrális indexet (SI) a spektrum és a peptidszám alapján alapul véve az előzőekben leírtak szerint számítottuk 58. Az azonosított fehérjék nyers spektrumszámát a következő képletekkel (1. és 2. képlet) normalizáltuk:
ahol C i az i futtatás teljes spektrális száma; y az összes összehasonlított futás átlagolt teljes spektrális száma; N i és R i egy fehérje normalizált és nyers spektrális száma az i futtatásban. Az SI,/Ci értéket használtuk az egyes futtatások teljes spektrumszámának normalizálására, a futás-futtatás variabilitás csökkentése érdekében.
Adatbányászat és bioinformatika
Az ebben a tanulmányban használt adatelemzést és professzionális szoftvereket a Kiegészítő anyagok és módszerek részletesen ismertetik.
Lektin/gliko-antitest mikrorajzok és adatelemzés
további információ
Hogyan idézhetem ezt a cikket: Qin, Y. és mtsai. A szérum glikopattern és a Maackia amurensis lektin-II kötő glikoproteinek autizmus spektrum rendellenességben. Sci. Rep. 7, 46041; doi: 10.1038/srep46041 (2017).
A szerkesztő megjegyzése: A Springer Nature semleges marad a közzétett térképekkel és intézményi kapcsolatokkal kapcsolatos joghatósági igényekkel szemben.
- Oroszország és Fehéroroszország uniója: Putyin manővere a hatalmon maradásért A Világrend -
- A pszichológia elmagyarázza a mértéktelen étkezési rendellenességek 5 okát
- Ezek a bipoláris rendellenesség tünetei
- A nők és a dohány az Európai Unióban
- A menstruációs rendellenesség és a termékenység kapcsolata CuidatePlus