A Spanyol Gyermekgyógyászati Szövetség egyik fő célja a gyermekgyógyászat különböző területeiről szóló szigorú és naprakész tudományos információk terjesztése. Az Anales de Pediatría az Egyesület tudományos kifejező testülete, és ez a hordozó, amelyen keresztül a munkatársak kommunikálnak. Eredeti műveket tesz közzé a gyermekgyógyászat klinikai kutatásairól Spanyolországból és Latin-Amerikából, valamint az egyes szakterületek legjobb szakemberei által készített áttekintő cikkeket, az éves kongresszusi közleményeket és a Szövetség jegyzőkönyveit, valamint a különböző társaságok/szakorvosok által készített cselekvési útmutatókat. A spanyol gyermekgyógyászati szövetségbe integrált szakaszok. A spanyol ajkú gyermekgyógyászat referenciáját a folyóiratot a legfontosabb nemzetközi adatbázisok indexelik: Index Medicus/Medline, EMBASE/Excerpta Medica és Index Médico Español.
Indexelve:
Index Medicus/Medline IBECS, IME, SCOPUS, Science Citation Index Expanded, Journal Citations Report, Embase/Excerpta, Medica
Kövess minket:
Az impakt faktor az előző két évben a kiadványban megjelent művek átlagosan egy évben kapott idézetek számát méri.
A CiteScore a közzétett cikkenként kapott idézetek átlagos számát méri. Olvass tovább
Az SJR egy tekintélyes mutató, amely azon az elképzelésen alapul, hogy az összes idézet nem egyenlő. Az SJR a Google oldalrangjához hasonló algoritmust használ; a publikáció hatásának mennyiségi és minőségi mértéke.
A SNIP lehetővé teszi a különböző tantárgyakból származó folyóiratok hatásának összehasonlítását, korrigálva az idézés valószínűségében a különböző tantárgyak folyóiratai között fennálló különbségeket.
- Összegzés
- Kulcsszavak
- Absztrakt
- Kulcsszavak
- Összegzés
- Kulcsszavak
- Absztrakt
- Kulcsszavak
- Bibliográfia
a heti otthoni szubkután gamma-globulin (GGSC) önadagolás alternatívát jelent az antitesttermelés hiányában szenvedő primer immunhiányos állapotok kezelésében. A cél a GGSC és az intravénás gamma-globulin (IVGM) hatékonyságának, biztonságosságának, életminőségének és éves költségeinek összehasonlítása és értékelése a környezetünkben.
Anyag és módszerek
megfigyelési és leíró vizsgálat általános változó immunhiányos (CVID) gyermekeknek, akik GGSC-t kaptak a központunkban (2006. november - 2008. április), összehasonlítva a GGIV utolsó évével.
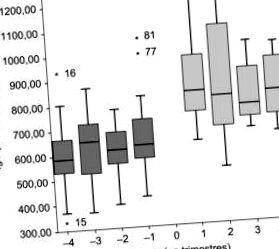
11 CVID-s beteget vontak be. Medián életkor, 15 év. A plazma IgG mediánja GGIV-vel, 622 mg/dl. Azoknál a betegeknél, akiknél a GGSC dózisa megmaradt vagy csökkent a korábbi GGIV-hez képest (7/8), a medián IgG 850 mg/dl volt (p
a szubkután terápia költséghatékony alternatívája az IVGN-nek, hasonló hatékonysággal és megnövekedett életminőséggel a CVID-ben szenvedő betegeknél. A kapott minimális plazma IgG-koncentrációk egyenlőek vagy nagyobbak. A helyi mellékhatások gyakoriak, de enyheek és korlátozottak.
A heti otthoni szubkután immunoglobulin (SCIg) terápia az intravénás immunglobulin (IVIg) alternatívája az elsődleges antitesthiányos betegek kezelésében. A tanulmány célja az SCIg hatékonyságának, biztonságosságának, a kapcsolódó életminőségnek és költséghatékonyságnak a vizsgálata volt a térségünkben.
Anyagok és metódusok
Megfigyelő és leíró vizsgálat, melyben kórházunkban (2006. november és 2008. április között) SCIg-t kapó, gyakori változó immunhiányos (CVID) gyermekbetegek vettek részt. A megszerzett adatokat összehasonlítottuk az elmúlt évi adatokkal az IVIg-vel.
Tizenegy CVID-s beteget vontak be. A medián életkor 15 év volt. Az átlagos minimális szérum IgG-szint 622 mg/dl volt IVIg mellett. Azoknál a betegeknél, akiknél az SCIg dózist fenntartották vagy csökkentették az IVIg-hez képest, a szérum minimális IgG-szint medián értéke 850 mg/dl volt (p
Megállapítottuk, hogy a 16% SCIg szubkután beadása biztonságos és költséghatékony alternatívája az IVIg-nek az elsődleges antitesthiány pótló terápiájában. A medián minimális szérum IgG-szint magasabb volt SCIg esetén. A helyi AE gyakoriak voltak, de enyheek, és az incidencia az idő múlásával csökkent. Az életminőség jelentősen javul.
Az elsődleges immunhiányok (PID) a genetikailag meghatározott betegségek csoportja, amelyeket az immunválaszban részt vevő különböző mechanizmusok mennyiségi és/vagy funkcionális megváltoztatása okoz. Körülbelül 1/10 000 újszülöttet (NB) érintenek, és az immunoglobulin A (IgA) hiánya a leggyakoribb (1/700 NB kaukázusi etnikum). A közös változó immunhiány (CVID) előfordulása 1,2-5/100 000 lakos 1. Klinikailag a fertőzések iránti fokozott hajlam jellemzi, főleg a légzőrendszer, az autoimmun betegségek és a daganatos folyamatok. A diagnózist az Európai Immunhiányos Társaság (ESID, www.esid.org) kritériumai szerint az IgG, IgA és/vagy IgM csökkenése állapítja meg az egyes életkorok normálértékei alatt, valamint az 2 évnél idősebb betegeknél korábban beadott vakcinákra adott válasz, kivéve a hipogammaglobulinémia egyéb okait. Kezelése nemspecifikus humán gamma-globulinnal (GG) történő helyettesítő terápia a fiziológiai értékekhez hasonló plazma IgG-koncentráció elérése érdekében.
Eddig az intravénás gamma-globulin (IVG) volt a szokásos kezelés ezeknél a betegeknél. 21–28 naponta 200–600 mg/kg adagolással lehet elérni a minimális 600 mg/dl IgG plazmakoncentrációt. A nehéz vénás hozzáférés és a potenciálisan súlyos szisztémás mellékhatások néha korlátozzák annak alkalmazását 4 .
1991-től kezdve a szubkután gamma-globulint (GGSC) kezdték használni Európában és az Egyesült Államokban. 100 mg/kg/hét vagy 200 mg/kg/14 nap 5–11 adagolása lehetővé teszi az IgG-koncentrációk elérését, hasonlóan az IVGG-vel kapott értékekhez. A GGSC-vel kapott IgG-értékek stabilabbak, mivel az alacsonyabb dózisok heti adagolása elkerüli a maximális koncentrációt és a minimális plazmakoncentrációt a beadott dózisok gyors katabolizmusa miatt 12 .
A GGSC hatékonyságát számos vizsgálatban értékelték 5,7,8,13,14 felnőtteknél és 13 év alatti 13 év alatti gyermekeknél, anélkül, hogy statisztikailag szignifikáns különbségeket mutatott volna a fertőzések számában és súlyosságában a kezelés során 7,13 .
A GGSC biztonsági profilja más, a súlyos szisztémás mellékhatások (AR) alacsonyabb százalékával (5,7,11,13,15,16. Ezzel szemben a helyi AR-k (fájdalom, erythema, induráció, viszketés stb.) a legtöbb betegnél a kezelés kezdetén jelentkeznek, általában enyheek és önkorlátozottak 5,7,8,13,15-18 .
A GGSC felajánlja annak lehetőségét is, hogy a beteg maga alkalmazza a családi házat, ami a beteg és családja életminőségének javulását jelenti. Ezt a szempontot különféle validált indexek és kérdőívek segítségével értékelték, mint például az életminőségi index (LQI), a gyermekgyógyászat gyermekgyógyászati kérdőív-parenterális 50-es formája (CHQ-PF50) és felnőtteknek szóló összefoglaló változata (SF-36) 3., 13,19–21 .
Különböző végzett gazdasági tanulmányok 6,8,15,22,23 azt mutatják, hogy a GGSC-vel végzett otthoni kezelés jelentős éves megtakarítást jelent az előző IVGG-kezeléshez képest.
2006 novemberében a Spanyol Gyógyszer- és Egészségügyi Ügynökség szubkután gamma-globulint (Vivaglobin ®; CSL Behring GmbH, Malburg, Németország, Németország) nyilvántartásba vett a PID, a myeloma és a krónikus limfatikus leukémia súlyos másodlagos hypogammaglobulinemia és visszatérő fertőzések kezelésére 10 . Ettől a pillanattól kezdve a központunkban PID-vel diagnosztizált gyermekgyógyászati betegeknél kezdődött a beadása.
A vizsgálat elsődleges célkitűzései a következők voltak: az IgG minimális értékeinek összehasonlítása a GGIV és a GGSC-vel, a fertőzések előfordulásának és súlyosságának meghatározása, valamint a GGSC biztonságosságának felmérése. A másodlagos célkitűzéseket tekintve az elégedettség mértékét és az életminőséget értékelték az otthoni GGSC-vel, és összehasonlították a betegenkénti éves költségeket a GGIV-vel és a GGSC-vel.
Anyag és módszerek Tanulmányterv
Megfigyelő, leíró, longitudinális retrospektív vizsgálat. Minden betegnél értékelték a GGIV-kezelés utolsó évét és a GGSC-vel való kezdetektől 2008 áprilisáig, az első évben a GGSC-re való áttérést követő 1., 3., 6. és 12. hónap utáni utólátogatásokkal. A demográfiai, analitikai és klinikai adatokat retrospektíven gyűjtötték a klinikai előzmények (CH) során. A szubkután kezelés megkezdése után két interjút készítettek a pácienssel és/vagy hozzátartozóival.
Beletették a GGSC-t 2006 novemberétől 2008 áprilisáig tartó betegeket, akik az elmúlt évben GGIV-t kaptak. A felvételi kritériumok a következők voltak: a) 18 év alatti és kg-os betegek; b) a CVID megerősített diagnózisa, és c) jó szociokulturális szint az eljárások megértéséhez és a megfelelő kezeléshez a GGSC-vel kapcsolatos káros hatások jelentkezése esetén. Kizárási kritériumok: a) 18 év feletti betegek; b) képtelenség megérteni az eljárást; c) súlyos vérdiszkrázia; d) bőrelváltozások, amelyek megakadályozzák a GGSC beadását; e) terhesség, és f) a beteg és/vagy hozzátartozói a vizsgálatba való belépés megtagadása.
A családtagok és maga a beteg (ha 16 évesnél idősebb volt) szóbeli és írásos tájékoztatást kapott a terápia GGIV-ről GGSC-re történő megváltoztatásáról, és aláírta a GGSC alkalmazásához szükséges tájékozott beleegyezést. A tanulmányt a Központ Klinikai Kutatási Etikai Bizottsága hagyta jóvá.
GGIV és GGSC gyógyszeres kezelés, dózis és beadási technika
Valamennyi beteg 16% Vivaglobin ® -ot (160 mg/ml) kapott.
A GGIV (Endobulin®) teljes havi dózisát (MTD) az utolsó 3 kapott GGIV dózis dózisából és beadásának gyakoriságából számítottuk ki, és elosztottuk 4-tel a heti GGSC kezdő dózisának megállapításához. A heti GGSC kezelést egy héttel az utolsó GGIV adag után kezdték el.
A GGSC-t hordozható infúziós pumpával adtuk be (Infusa T1 modell, a Medis-től). A 20 ml-nél nagyobb adagokat két szúrási helyre osztottuk. A szúrás helye a hasfal volt, és az adagolás sebessége 10–22 ml/h 10 volt .
Az otthoni terápia megkezdése előtt 8 edzést tartottak a kórházban. Beszámoltak a szivattyú kezeléséről és az infúziós technikáról, a kezelési napló vezetésének fontosságáról és az intramuszkuláris adrenalin beadásának technikájáról súlyos AR esetén. A GGSC megkezdése után 1, 3, 6 és 12 hónappal utólagos látogatásokat tettek.
Periodikus vizsgálatokat végeztek 3 havonta az IgG, IgA és IgM plazma evolúciójának nephelometriai technikákkal történő meghatározására.
Az IVIG fertőzéseket az elmúlt évben 2008 áprilisáig regisztrálták. A fertőzéseket helyük szerint osztályozták: a) felső légúti fertőzések (URI): rhinitis, pharyngitis, gégegyulladás, felső légúti hurut (CVA), kötőhártya-gyulladás, sinusitis és akut középfülgyulladás (AOM); b) alsó légúti fertőzések (IRTI): hörghurut és tüdőgyulladás; c) emésztőrendszeri fertőzések és d) egyéb fertőzések. A kórházi felvételt igénylő fertőzéseket súlyosnak tekintették (agyhártyagyulladás, tüdőgyulladás, szepszis, osteomyelitis és zsigeri tályogok).
A GGSC biológiai biztonságának értékelése érdekében 3 hónappal a GGSC megkezdése előtt és 3 hónappal a hepatitis B (HbsAg EIA által), a hepatitis C (RNS-HCV valós idejű PCR-rel, Tacqman rendszer - Roche ®) vírusfertőzés hiánya és a HIV vírusterhelése (NASBA). A HC-ben regisztrált ápolás és a naplójában szereplő beteg, a gyógyszeres kezelésből származó szisztémás vagy lokális AR-hoz kapcsolódó jelek vagy tünetek. Az RA-t súlyosnak tekintették, ha kórházi kezelést igényelt.
Elégedettség és életminőség a GGSC-vel
A GGSC elfogadásának mértékének értékeléséhez két interjút terveztek ehhez az eljáráshoz (nem adaptálva a gyermekgyógyászatra érvényes LQI vagy CHQ-PF50 kérdőívekhez). Az első interjút a kórházi betegek edzésének befejezése után, a másodikat pedig 4 hónappal a GGSC megkezdése után készítettük.
A GGIV és a GGSC éves gazdasági értékelése
Összehasonlítottuk a GGIV-vel (Endobulin ®) végzett kezelés utolsó évének és a GGSC-vel (Vivaglobin ®) végzett első vagy azt követő év éves költségeit. A gyógyszerek és kiegészítők laboratóriumi eladási árát (PVL), valamint az áfát az egyes gyógyszeripari termékek gyártó laboratóriumából szerezték be (konzultáció, 2008. április).
Az adatok statisztikai elemzését az SPSS (V15.0) és az Excel statisztikai programmal végeztük. A következő változókat vizsgálták: a) hatékonyság: az IgG plazma-mélysége, az egyes GG-k hozama, a fertőzések száma; b) biztonság: helyi és szisztémás mellékhatások, vírusfertőzések (HBV, HCV, HIV); c) az elégedettség mértéke a beadott kérdőívek szerint, és d) költség: betegenkénti éves kiadás.
Az IgG minimális plazmakoncentrációjával történő hatékonyság meghatározásához minden egyes alkalmazott GG-típusra teljesítményt kaptunk, elosztva az IgG minimális plazmakoncentrációját (mg/dl) a kapott GG dózisával [mg/(kg/hét) ] [hozamegységek: (kg/hét)/dl]. A teljesítmény összehasonlítását mindkét csoport között a párosítatlan minták átlagának összehasonlításával végeztük. Több változó lineáris regresszióval értékeltük az "alapszintű IgG a diagnózis idején" és "az alkalmazás módja" hatását a plazma IgG-koncentrációra (mg/dl). A GGIV-vel és a GGSC-vel végzett kezelés során a betegre jutó szisztémás és lokális AR-k fertőzési arányát és arányait összehasonlítottuk a nem paraméteres Wilcoxon t teszttel. A beteg életkorának, súlyának és plazma IgG-értékének, a GG dózisának és gyakoriságának értékeit a medián és interkvartilis tartományban fejeztük ki.
Eredmények Vizsgálati populáció
Tizenegy beteget (7 fiú és 4 lány) diagnosztizáltak CVID-vel az ESID kritériumai szerint, kivéve a rutin klinikai gyakorlat szerinti egyéb diagnózisokat. A vizsgálat során egyetlen alany sem veszett el. Az 1. táblázat a legfontosabb demográfiai és klinikai adatokat sorolja fel. A 2 éves kor előtt diagnosztizált 3 betegnek klinikai tünetei voltak és az IDC családjában anamnézis volt, és ezt a diagnózist minden esetben megerősítették idősebb korban.
A betegek demográfiai és klinikai jellemzői.
- Mario Picazo megpróbáltatásai, amikor első kézből tapasztalta az UCLA lövését
- Jennifer Lawrence megalázó tapasztalata, hogy szerepet kapjon
- A testtömeg összetétel-kontroll változóként történő alkalmazásának kényelmetlensége
- Az infláció június első felében megnő az Inegi% -nál
- Nagyon vékony és nem eszik jól - ELSŐ DADDIES