Iatrogén Cushing-szindróma csecsemőben a helyi kortikoszteroidok hosszan tartó alkalmazása miatt. Esetleírás
Javiera Hansen S. A
Patricia Lacourt R. B
Gyermek endokrinológiai osztály, Gyermekgyógyászati Osztály. Orvostudományi Kar, Pontificia Universidad Católica de Chile. chili.
B Gyermek endokrinológiai osztály, Gyermekorvosi Kórház Dr. Sótero Del Río. chili.
A Cushing-szindróma (CS) endokrinológiai patológia a glükokortikoidok feleslegéből adódóan, kortikotropin hormontól (ACTH) függő vagy attól független. A fő ok iatrogén a glükokortikoidok túlzott használata miatt.
A helyi kortikoszteroidok hosszan tartó alkalmazása és a CS kialakulása közötti összefüggés bemutatása.
Korábban egészséges idősebb csecsemő, akit seborrheás dermatitis miatt helyi kortikoszteroidokkal kezeltek. A hosszan tartó, felügyelet nélküli használat miatt Cushing-szindrómával fejlődött ki, amelyet elhízás és kompromittált növekedési sebesség jellemez. A helyi alkalmazást felfüggesztették, és a terápiát csökkentő fiziológiai helyettesítő dózissal kezdték, elérve a klinikai javulást.
A helyi kortikoszteroidokat széles körben használják a klinikai gyakorlatban a dermatológiai patológiák kezelésére. Ezek különféle prezentációkban és erősségekben állnak rendelkezésre. Hatásában a fő meghatározó tényezők a következők: a bőr jellemzői, a gyógyszer hatóanyaga, hatalma és alkalmazási technikája, így a pelenka kiütéseknél gyakrabban figyelhetők meg a káros hatások. A hosszan tartó alkalmazás fő káros hatása a Cushing-szindróma kialakulása, amelyet felügyelt alkalmazással és fokozatos csökkentéssel lehet megakadályozni.
A helyi kortikoszteroidok ésszerű és körültekintő alkalmazása elengedhetetlen a jótékony hatások kihasználása és a mellékhatások megjelenésének elkerülése érdekében.
Kulcsszavak: Cushing-szindróma; helyi glükokortikoidok; Káros hatások; kortikoszteroidok
A Cushing-szindróma szisztémás endokrin rendellenesség, a kórosan magas plazma kortizolszint eredménye. A CS előfordulása pontatlan, különösen a gyermekpopulációban. Összességében a leggyakoribb ok iatrogén, másodlagos a glükokortikoidok túlzott exogén beadása miatt. Az endogén CS-t illetően ez a kortikotropin (ACTH) hormon szekréciójának növekedésétől függően vagy függetlenül fordulhat elő. Az endogén CS-ben a Cushing-kór (kortikotrop adenoma) az esetek 60-70% -ában fordul elő 5 évnél idősebbeknél, és az ektopiás ACTH termelést figyelembe kell venni a differenciáldiagnózisban, és kivételesen a kortikotropin-felszabadító hormon (CRH) ektópiás termelésében. . Az ACTH-független eseteket tekintve a krónikus hiperkortizáció negatív visszacsatolással gátolja a CRH és az ACTH 2 szekrécióját. Ebben a csoportban javasoljuk az egyoldalú (adenoma/carcinoma) vagy a bilaterális (makro vagy mikronoduláris mellékvese hiperplázia) mellékvese elváltozásának értékelését, különösen 5 évesnél fiatalabb gyermekeknél 11 .
A helyi glükokortikoidok alkalmazása fontos eszköz a dermatológiai terápiában, erőteljes gyulladáscsökkentő és proliferatív hatásának köszönhetően. Azonban a hatásos topikális kortikoszteroidok tartós expozíciója másodlagos káros hatásokat okozhat, mint például a bőr megnyilvánulása (corticoderma), a növekedés csökkenése és a hipotalamusz-hipofízis-mellékvese (HHA) tengelyének elnyomása, különösen megfelelő orvosi felügyelet hiányában.
A bemutató célja az összefüggés bemutatása a helyi kortikoszteroidok hosszan tartó alkalmazása és a káros hatások (Cushing-szindróma és kompromittált növekedési sebesség) között.
Férfi 1 év 2 hónapos vizsgálatra felkérésre, alacsony termetre, károsodott növekedési sebességgel 6 hónapos kortól. A nem rokon szülők első gyermeke, kontrollált fiziológiai terhesség. 40 hetes, terhességi korra alkalmas újszülött (RNT AEG), 3195 g születési súlyú és 49 cm hosszú, patológiák nélkül az újszülött korában. Nem írnak le releváns kórtörténetet.
A gyermekgyógyászati endokrinológiai poliklinikán végzett első értékelés során kiemelkedett egy jellegzetes cushingoid fenotípus, ezért közvetlenül kérték a kortikoszteroidok alkalmazását. Az élet harmadik hónapjában a beteget a CESFAM-ban értékelték a fejbőr és a perineal területén jelen lévő dermatitis képe miatt, az előzetes atópiás dermatitis előzménye nélkül. Ezt figyelembe véve a klotrimazollal társított 1% -os hidrokortizon-acetát krémmel történő helyi kezelést jelezték. Ezt követően a beteg dermatológiai tünetekkel fennállt, amelyek indikációját 0,05% -os betametazon-dipropionát krémre változtatták. A kezelésre adott jó kezdeti klinikai válasz miatt az anya minden moltban fenntartotta a krém használatát, elérve a 10 hónapos folyamatos kezelést, anélkül, hogy az egészségügyi csapat újból értékelte volna. A betegnek nem volt más releváns személyes vagy családi története.
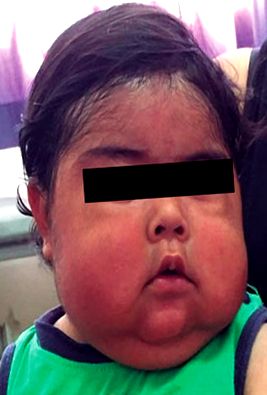
A fizikális vizsgálat idején a páciens egy kis szemű, ponty szájjal, duzzadt arccal, bitemporális zsírral, hipertrichózissal és kettős állal ellátott cushingoid fácieseket mutatott be (1. ábra). Antropometriai értékelésén belül a csökkent magasság/életkor összefüggés a Z-ponttal -4,26, a megnövekedett súly/magasság viszony pedig a Z-ponttal +2,93 (2. ábra) emelkedett ki. Hasonlóképpen, a vérnyomás emelkedését (BP 108/64 Hgmm) vizsgálták, figyelembe véve a 95. percentiliset (BP 102/54 Hgmm) nem, életkor és magasság szerint 12. A vizsgálat további része jelentős változások nélkül, kivéve az enyhe perinealis erythema fennmaradását.
1. ábra Első járóbeteg-konzultáció 1 éves és 2 hónapos korban.
2. ábra Növekedési görbe a növekedési sebesség kezdeti romlásával.
Felvetődött az elhízással, az 1. másodlagos stádiumú magas vérnyomással (HT) és a gyenge növekedési rátával járó alacsony termetű iatrogén Cushing-szindróma gyanúja. A kezdeti kezelés során jelezték, hogy azonnal felfüggesztik a helyi kortikoszteroidok alkalmazását, és a hidrokortizon-kezelést orálisan (po) magas fiziológiai dózistartományban (13,5 mg/m 2/nap) kezdték meg, oktatva magunkat az arc dózismódosítására vonatkozóan. az akut patológia. A hipertónia kezelését illetően átmenetileg hidralazinnal kezelték (1,5 mg/kg/nap vagy 8 óránként frakcionálták) a Gyermek Nefrológiával közös értékelés szerint. Kiindulási biokémiai vizsgálatot kértek vegyes diszlipidémia (összkoleszterin = 213 mg/dl és trigliceridek = 153 mg/dl), normális pajzsmirigyfunkció és késleltetett csontkor (OS) (OS 6 hónap kronológiai életkor esetén 1 év 3 hónap) kimutatására.
A páciens kedvezően fejlődött a Cushing-jelek fokozatos csökkenésével (3. ábra), amely a növekedési sebesség javulásával és a fokozatos súlycsökkenéssel járt együtt. Az orális hidrokortizon (13 mg/m 2/nap) 6 hónapos szubsztitúciós kezelés befejezése után progresszív csökkenést kezdtek 10 mg/m 2/nap értékre, és reggeli bazális kortizol-mérést kértek a lehetséges szuszpenzió értékeléséhez. A vizsgálat 7,3 ug/dl alapszintű kortizolt mutatott, amelynek fiziológiás dózisát fenntartották (8 mg/m 2/nap vo), és mikrodózisú ACTH tesztet (1 ug) kértek. Ezt a tesztet végül egyéves hidrokortizon-kezelés után hajtották végre, amelynek eredményeként az pre-ACTH kortizol értéke 6,32 ug/dl volt, az ACTH utáni kortizol pedig 24,2 ug/dl (normál referenciaérték> 18 ug/dl). a gyógyszeres kezelést abbahagyták.
3. ábra Az orális kortizollal végzett kezelés 3 hónapos, 9 hónapos és 1 éves kezelése.
A helyi kortikoszteroidokat széles körben használják a gyermekpopulációban különböző dermatológiai patológiák kezelésére. Ezek különféle kiszerelésekben, koncentrációban és hatékonyságban állnak rendelkezésre 4, az I – VII. Csoportba sorolva, ez utóbbi jellemző 5-7 szerint (1. táblázat) 10. A klobetazol-propionát a leghatékonyabb készítmény, amely a szisztémás mellékhatásokhoz társul, de bármely elegendő mennyiségben, időtartamban és kiterjesztésben alkalmazott kortikoszteroid előállíthatja őket 5 .
1. táblázat A helyi kortikoszteroidok osztályozása potencia és hordozó szerint. 6.
Négy meghatározó tényezőt írnak le a helyi kortikoszteroidok alkalmazásakor, amelyek a mellékhatások kialakulásának nagyobb kockázatával járnak: bőr (terület, a gát kiterjesztése és kártérítése), a gyógyszer hatóanyaga (potencia), vivőanyag (a kiszerelés formája) és a technika. alkalmazás (dózis, a kezelés gyakorisága és időtartama) * 4, 9) .
Gyermekeknél a lehető legalacsonyabb hatékonyságú topikális kortikoszteroidok használata ajánlott (1. táblázat), értékelve a felszívódást a gyógyszer megjelenése szerint, figyelembe véve a nagyobb felszívódást nagyobb ropogás esetén (kenőcs> krém> gél> krém> aeroszol> por) . Ami a bőrt illeti, a gyermekek különösen érzékenyek a szisztémás mellékhatások kialakulására, mivel a bőrfelület súlyukhoz viszonyítva nagyobb arányban fordul elő (3, 5). A bőr soványsága magasabb fokú felszívódással jár, különösen olyan területeken, mint a nyálkahártya, a herezacskó és a szemhéjak. Másrészt a bőr hidratálása (előző fürdés), a súrlódás és az elzáródás elősegíti a gyógyszer behatolását. Ebben az összefüggésben a fokozott felszívódás fő kockázati tényezői a gátolt funkció elvesztésével járó gyulladt bőrre történő felvitel, valamint a vékonyság miatt kezelt anatómiai régió bizonyos jelzett területeken (nyálkahártya és herezacskó) 4 .
A patológia, amelyet mindkét tényező jelenléte jellemez, a pelenka allergiás kontakt dermatitise. Ezt az állapotot meg kell különböztetni az irritáló pelenka kiütéstől (az esetek 90% -a), mivel a kezelés jelentősen megváltozik. Míg az allergiás dermatitisz helyi kortikoszteroidokkal és végül kalcineurin-gátlókkal kezelhető a bőrgyógyász szakorvosának értékelését követően, az irritáló derma titis a bőrgát helyreállítását helyezi előtérbe olyan általános intézkedések révén, mint például a pelenka gyakori cseréje és az esetleges interakciós gombás fertőzés kezelése.
Általában a helyi kortikoszteroidok kezdeti indikációját a dermatológiai patológia kezelésének előnyei igazolják 9, és megfelelő alkalmazásuk emellett ritkán okoz enyhe mellékhatásokat, figyelembe véve a legalacsonyabb hatású kortikoszteroid kiválasztását a betegség megfelelő kezelésére. 5. út A fentiek miatt az egészségügyi csapatnak utasítania kell a beteget e gyógyszerek helyes használatára, és oktatnia kell őket a lehetséges káros hatásokról 5 .
A helyi kortikoszteroidok hosszan tartó alkalmazásának mellékhatásai közé tartozik a HHA tengely szuppressziója és a Cushing-szindróma károsodott növekedési sebesség mellett. Az exogén kortikoszteroidok miatt másodlagos H-H-A tengely szuppresszió a mellékvese-elégtelenség leggyakoribb oka 8, és a hatásos kortikoszteroidokkal kezelt betegek akár 48% -ánál is megfigyelhető. A szuppresszió kockázata nő a beadott dózistól és a kezelés időtartamától függően. Hasonlóképpen, a mellékvese tengely funkcionalitásának helyreállítási időszaka arányos a szupresszió idejével és intenzitásával, és hetek vagy hónapok is igénybe vehetik az újbóli aktiválódást. A CS tekintetében a jellegzetes klinikai típus gyakori, míg a növekedési görbe romlása kevésbé ismert. A CS klinikai gyanúja esetén a hypercortisolism jelenlétét biokémiai/hormonális úton kell igazolni. Ezután megerősítés után javasoljuk egy olyan tanulmány befejezését, amelynek célja az ok megállapítása a plazma ACTH mérésével és adott esetben a képalkotás értékelésével.
A bemutatott eset és az iatrogén ok nagyobb gyakorisága összefüggésében a kezelés alapvető szempontja a helyi kortikoszteroid szuszpenziója és hidrokortizonnal történő kiegészítése fiziológiai dózisokban (9-12 mg/m 2/nap) az enterális vagy pa renteral. Hasonlóképpen, a pótlás csökkenését fokozatosan és fokozatosan kell végrehajtani, hogy lehetővé váljon a tengely újbóli aktiválása és a mellékvese megfelelő működése. A nyomon követés során fontos szempont az akut interakciós patológia elleni oktatás és megelőzés, a mellékvese-krízis kiváltásának magas kockázata miatt, ha a dózist ideiglenesen nem emelik a stressz kezelésére.
Végül meg kell jegyezni, hogy ajánlott a megfelelő mellékvese működését felmérni a kiindulási kortizol- és/vagy az ACTH-teszt mérésével, ez utóbbi tekinthető a 4, 5 aranystandardnak. .
Betegünk a kortikoszteroidok feleslegének klasszikus klinikai tüneteivel járt. Csecsemőkorban a növekedési sebesség elvesztésével járó súlygyarapodás által jellemzett antropometrikus mintának Cushing-szindróma gyanújához kell vezetnie a differenciáldiagnózisban. A helyi kortikoszteroidok ésszerű és körültekintő alkalmazása több terápiás előnnyel jár, és elkerülheti a fontos mellékhatások megjelenését.
Emberek és állatok védelme: A szerzők kijelentik, hogy az alkalmazott eljárások összhangban voltak a felelős humán kísérleti bizottság etikai normáival, valamint az Orvosi Világszövetség és a Helsinki Nyilatkozattal.
Az adatok bizalmas kezelése: A szerzők kijelentik, hogy betartották munkaközpontjuk protokolljait a betegadatok közzétételével kapcsolatban.
A magánélethez és a tájékozott beleegyezéshez való jog: A szerzők megszerezték a cikkben említett betegek és/vagy alanyok tájékozott beleegyezését. Ez a dokumentum a megfelelő szerző birtokában van.
Összeférhetetlenség: A szerzők nem jelentenek összeférhetetlenséget.
1. Ashish T, Manjusha G, Pankaj P, Poorva G. Helyi-szteroidok által kiváltott iatrogén Cushing-szindróma gyermekkori korcsoportban: Ritka esetjelentés. Indián J Endocrinol Metab. 2013; 17 (1. kiegészítés): S257-8. [Linkek]
2. Kling MA, Roy A, Doran AR és mtsai. Cerebrospinalis folyadék immunreaktív kortikotropin-felszabadító hormon és adrenokortikotropin-szekréció Cushing-kórban és súlyos depresszióban: lehetséges klinikai következmények. J Clin Endocrinol Metab 1991; 72: 260. [Linkek]
3. Pranab S, Nilendu S, Nilanjan S, Prashant S. A csontritkulás és hipogonadizmus helyi szteroidja által kiváltott jatrogén Cushing-szindróma virágos esete. Indiai J Dermatol. 2015; 60 (4): 420. [Linkek]
4. Dhar S, Seth J, Parikh D. A helyi kortikoszteroidok szisztémás mellékhatásai. Indiai J Dermatol. 2014; 59 (5): 460-4. [Linkek]
5. Casado-Verrier B, Sanz-Canalejas L, Gómez-Fernández C, Pagán B, López M, Casado-Jiménez M. Iatrogenic Cushing-szindróma topikális kortikoszteroidok miatt két felnőttnél. Med Cutan IberLat Am 2012; 40 (2): 58-61. [Linkek]
6. A WHO felírási modellje: bőrbetegségekben alkalmazott gyógyszerek. 1999. [Linkek]
7. Decani S, Federighi V, Baruzzi E, Sardella A, Lodi G. Iatrogenic Cushing-szindróma és helyi szteroidterápia: esetsorok és az irodalom áttekintése. J Dermatol Treat. 2014; 25: 495-500. [Linkek]
8. Messazos B, Zacharin M. Az iatrogén Cushing-szindróma tanulságai gyermekeknél. J Paediatr Gyermekegészségügy. 2016; 52: 1106-10. [Linkek]
9. Motes M, Suárez E, Velázquez P, Cedeño Y. Cushing-szindróma szteroidos krémekkel történő kezelés után. Holguín Medical Scientific Mail 2008: 12 (5). [Linkek]
10. Hengge UR, Ruzicka T, Schwartz RA, Cork MJ. A helyi glükokortikoszteroidok káros hatásai. J Am Acad Dermatol. 2006; 54 (1): 1-18. [Linkek]
11. Lacroix A, Feelders R, Stratakis C, Nieman L. Cushing-szindróma. Gerely. 2015; 386 (9996): 913-27. [Linkek]
12. Flynn JT, Kaelber DC, Baker-Smith CM és mtsai. Klinikai gyakorlati útmutató a magas vérnyomás szűrésére és kezelésére gyermekeknél és serdülőknél. Gyermekgyógyászat. 2017; 140 (3): e20171904. [Linkek]
Beérkezett: 2017. szeptember 06 .; Jóváhagyva: 2018. január 24