Összegzés
Ez a protokoll megbízható módszert biztosít humanizált egerek létrehozására az emberi immunrendszerrel és a májsejtekkel. Az emberi hepatociták és a CD34 + hematopoietikus őssejtek intrasplenikus injekciójával elért helyreállított kettős immunhiányos egerek hajlamosak az emberi immunhiányos vírus-1 fertőzésre és a HIV-fertőzött betegeknél megfigyelt összesített májkárosodásra.
Absztrakt
Bevezetés
Az antiretrovirális terápia megjelenése óta jelentősen csökkent a HIV-1 monoinfekcióval összefüggő halálozások száma. A májbetegség azonban a HIV-fertőzött betegek 1, 2 általános megbetegedésének oka. A hepatitis vírus együttes fertőzése a HIV-1 fertőzéssel gyakoribb, az Egyesült Államokban a HIV-fertőzöttek 10-30% -át teszi ki 3, 4, 5 .
Előfizetés szükséges. Kérjük, ajánlja a JoVE-t könyvtárosának.
Jegyzőkönyv
Ezt a protokollt a Nebraskai Egyetem Orvosi Központjának Intézményi Állatgondozási és Felhasználási Bizottsága (IACUC) hagyta jóvá.
JEGYZET: Állatkísérletek elvégzése előtt szerezze be a helyi IACUC jóváhagyását.
1. A köldökzsinórvér feldolgozása és a shumano HSpC izolálása
2. Humán hepatociták előkészítése transzplantációra
- Távolítsa el a mélyhűtött hepatocitákat a folyékony nitrogénből, gyorsan merítse az injekciós üveget a vízfürdőbe, és kb. 90 - 120 másodpercig olvasztsa fel.
- Távolítsa el a kupakot az injekciós üvegből, és öntse a megolvasztott hepatocitákat az 50 ml-es kúpos, melegített felolvasztó közegbe.
- Szuszpendálja a sejteket úgy, hogy néhány másodpercig kézzel ringatja az 50 ml-es csövet.
JEGYZET: Ne vortexelje a csövet. - A sejteket 100 x g-nél 8 percig szobahőmérsékleten taszítjuk. Mossuk a pelletált sejteket PBS-ben 0,1% BSA-val, és rázzuk fel friss vagy felolvasztott HSCC-vel (10: 1 arányú) PBS-ben 80 μl/egér végtérfogatban.
3. Állatkezelés, szűrés, genotipizálás és kezelés humán hSPC és hepatocita transzplantáció esetén
4. Az emberi májgraft validálása ELISA-val és az emberi immunrendszer áramlási citometriával
JEGYZET: Az emberi máj és az immunrendszer helyreállítását havonta, a transzplantáció után 1 hónappal kezdve, enzimhez kapcsolt immunszorbens vizsgálattal (ELISA) és áramlási citometriával kell értékelni.
5. A TK-NOG egerek HIV-fertőzése és hatása az emberi májra és immunrendszerre
Előfizetés szükséges. Kérjük, ajánlja a JoVE-t könyvtárosának.
Reprezentatív eredmények
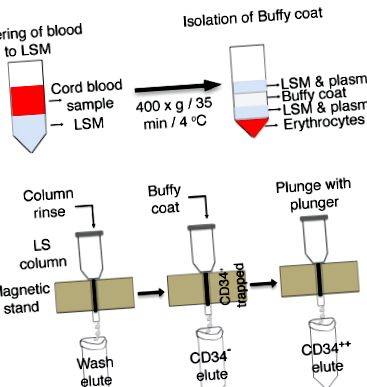
1.ábra : A köldökzsinórvérből származó CD34 + sejtek dúsításának vázlata. (NAK NEK) A zsinór vért limfocita szeparációs táptalajba (LSM) rétegezzük, és a buffy réteg izolálása céljából centrifugáljuk. (B) Az LS oszlopokat egy mágneses állványra helyezzük és BSA pufferrel öblítjük, majd egy buffy réteg hozzáadásával. A CD34-re pozitív sejteket csapdába ejtjük az oszlopokban, és a CD34-sejteket külön csövekben eluáljuk. Az oszlopgyantákba befogott CD34 + sejteket elvetjük, és a sejteket egy új csőbe gyűjtjük. Kattintson ide az ábra nagyobb változatának megtekintéséhez.
4. ábra : Az albumin koncentrációt ELISA módszerrel mértük a kettős humán egerek szérumában. Az egereket humán hepatocitákkal (HEP) és CD34 + ős/progenitor hematopoietikus sejtekkel (HSPC) ültetjük át (# 11). A szérumot az átültetés után 1, 4 és 6 hónappal különböző időpontokban gyűjtik össze, és hígításokat végeznek, hogy az ismeretlen mintakoncentrációkat beállítsák a standard tartományban. Minden szimbólum egyedi egérértéket képvisel. Az eredmények a medián mellett az egyéni értékeket is képviselik. * P 8. Kattintson ide az ábra nagyobb változatának megtekintéséhez.
5. ábra: Hatással van vmire HIV-1 a szérum albuminszintben és az emberi CK18 + hepatocyták kimerülése kettős emberi egerek májában. (NAK NEK) Az albumin koncentrációját nem fertőzött egerekben (# 9) monitorozzuk humán HEP-kkel és HSpC-kel átültetve 1 és 4 hónapon belül. Az egereket a transzplantáció után 4-5 hónappal HIV-fertőzte (n x 10), és a fertőzés után 5 héttel feláldozták őket. Minden szimbólum egyedi egérértéket képvisel. Az eredmények a medián mellett az egyéni értékeket is képviselik. * P 8. (B) A nem fertőzött TK-NOG egerek (HEPs + HSP, bal oldali panel) és a HIV-fertőzött TK-NOG egerek (HEPs + HSCCP + HIV, jobb oldali) öt mikronos májszakaszait rögzítettük, paraffinba ágyazottuk és a citokeratin-18-ra festettük. (CK18) anti-humán antitestek. A CK18 + hepatocyták kimerülését okozó HIV-1-et az emberi CK18 + sejtek által kevésbé elfoglalt terület bizonyítja. Az itt bemutatott eredmények egy nem fertőzött egérből és egy HIV-fertőzött egérből származnak, amelyet két emberi hepatocitával és HSPC-vel transzplantáltak.
6. ábra : CD4 + sejtek és CD8 + T aránya a HIV-1 által nem fertőzött és megfertőzött rekonstruált kettős egerek perifériás vérében és májában. Dupla helyreállított, nem fertőzött egerek esetében: zárt kör; HEP-ek + HSPC-k; vér # 7; máj # 6. HIV-1-fertőzött egereknél: nyitott körök; HEP-ek + HSPC-k + HIV; vér n-től 10-ig; máj # 11. Az eredmények a medián mellett az egyéni értékeket is képviselik. * P 8. Kattintson ide az ábra nagyobb változatának megtekintéséhez.
Előfizetés szükséges. Kérjük, ajánlja a JoVE-t könyvtárosának.
Vita
Jelenleg a kettős humanizációt humán CD34 + HSCCP és magzati májsejtek transzplantációja mutatja; Az újszülött állatok kezelése azonban technikai problémákat okoz 13, 14. A HSCCP-k több forrásból származhatnak vagy izolálhatók, például magzati májsejtekből (FLC), embrionális őssejtekből (ESC) és CB-ből. Az etikai kérdések azonban korlátozzák az ESC-k és az FLC-k használatát. A CB-nek nincs ilyen korlátozása, és hasznosabb alternatíva a HSCCP megszerzéséhez, valamint a primitív vérképző ős- és progenitorsejtek értékes forrása, amely helyreállíthatja a funkcionális immunrendszert. A köldökzsinórvér nem lehet egy napnál régebbi, ha a HSCCP-ket izolálják, mivel a HSCCP-k teljesítményét nagymértékben befolyásolja az életkor. Az izolált HSCCP-k tisztaságát ellenőrizni kell a sejtek krioprezerválása előtt. Kerüljük a CD3 + T limfociták keresztszennyeződését, mivel ez szisztémás egér-gazdaszervi transzplantátum betegséghez és a HPH akut allorejektálásához vezethet, miközben nem illő sejtekkel transzplantálunk.
Kereskedelemben kapható májsejteket használtak a máj helyreállításának forrásaként 8, 13. A felnőtt májsejtek előnyösek a máj helyreállítása szempontjából, mivel nagyobb az oltás hatékonysága és a hosszú távú fenntarthatóságuk 29.
Az emberi immunrendszer egérmodellben való jelenléte megnövelte az ALB szintet, amint azt korábban bemutattuk 30, 31. A hepatociták hatékonysága és az immunrendszer helyreállítása azonban a donorsejtek különböző forrásaitól függően változhat, és a fogadó egértől függ. Ezért minden egeret ki kell értékelni a beültetés szempontjából, és a legkritikusabb az olyan antitestek vagy reagensek használata, amelyek specifikusak az emberre és nem reagálnak keresztre az egérsejtekkel. Az itt bemutatott vizsgálatban alkalmazott emberspecifikus reagenseket és antitesteket a Anyagtáblázat. Ha a Anyagtáblázat a vizsgálathoz feltétlenül ellenőrizze az emberi sajátosságokat.
Az optimális feltétel a szingenikus sejtek átültetése lenne; ezt azonban technikailag nehéz megvalósítani. Amikor csak lehetséges, a HSCCP-ket és a hepatocytákat össze kell gyűjteni a donoroktól, részben párosítva az 1. osztályú humán leukocita antigénekkel (például HLA-A2).
Az egerek HIV-vizsgálatok céljából történő vizsgálatához több időpontban vért veszünk az optimális máj- és immunkonstitúció meghatározása érdekében; Az áramlási citometriát és az ELISA-t részesítik előnyben, mivel ezek csak kis mennyiségű vérrel végezhetők el. Ugyanabból a mintából származó vérsejtek és szérum használhatók áramlási citometriához és ELISA-hoz. Fontos, hogy minden időpontban megfelelő szérumhígításokat hajtsunk végre (1000 - 40 000 tartomány) az ALB szintek felmérése érdekében, hogy az ismeretlen koncentrációk a standard koncentráció tartományba kerülhessenek (készlet tartomány: 6,25 - 400 ng/ml).
Az emberi immunrendszer jelenlétében a HIV-1 fertőzésre adott válaszként gyulladásgátló citokinek szintén hasznosak lehetnek a hepatociták és az immunsejtek kölcsönhatásának kezelésében. A modell hasznos a HIV-1 által kiváltott májbetegség immunopatogenezisének bemutatásában, mivel a májkárosodást ugyanúgy összegzi, mint az embereknél, amit alacsony CD4: CD8 arány, az ALB szintjének csökkenése, az emberi hepatociták által okozott halál és immunmáj Aktiválás. A modellnek vannak bizonyos korlátai is, mint például a citotoxikus T-sejtek alacsony szintje és az immunoglobulin-osztály kapcsolásának zavara. Az emberi immunrendszer és a máj jelenléte miatt az itt bemutatott modell ígéretes a HIV-1 vírus és a hepatitis együttes fertőzései, a krónikus hepatitis fertőzés szempontjából (a hepatitis elleni immunválasz mechanizmusainak tisztázása érdekében), és mivel cirrhosis modell.
Előfizetés szükséges. Kérjük, ajánlja a JoVE-t könyvtárosának.
- Bar Refaeli csúcsmodell elárulta a tökéletes test megőrzésének titkát
- A Dual FP nem indul el, csak 3 százalékkal több hallgatót vett fel és 18 vállalatot veszített el - a La Nueva
- Glucoject Dual Plus Lancing Device 1Ud
- Beszéljünk a Disney fórumról - Mickey Mouse története - A PATKÁK GARÁZSA; N
- Májkiegészítők most Ételek Májfrissítés
