- Tárgyak
- Összegzés
- Bevezetés
- Eredmények
- A máj miRNS-ek differenciális expressziója fibrózisos steatohepatitisben szenvedő egerekben
- Microarray-alapú gén ontológiai elemzés és útvonal-elemzés differenciálisan expresszált miRNS-ekhez
- A miRNS expressziójának validálása kvantitatív valós idejű PCR-rel (qRT-PCR)
- Az miR-146a-5p-t alacsonyan szabályozták az aktivált HSC-kben in vitro
- A MiR-146a-5p túlexpresszió elnyomta a HSC proliferációt
- A miR-146a-4p hatása a HSC aktiválására és a kollagén lerakódására
- Az miR-146a-5p közvetlenül a Wnt1 és Wnt5a mRNS 3'UTR-jére hatott
- Az miR-146a-5p negatívan szabályozza a Wnt1 és Wnt5a szintet a poszttranszkripciós szinten
- A miR-146a-5p túlzott expressziójának és gátlásának hatása a célgénekre a Wnt jelátviteli útvonal után
- A Wnt1 vagy Wnt5a csökkenése gátolta a downstream Wnt szignalizáció és fibrogenezis gén expresszióját
- Vita
- Mód
- Alkoholmentes szálas steatohepatitis állatmodelljei
- Szövettani és biokémiai elemzés.
- MicroRNS Microarray Assay
- QRT-PCR elemzés
- A potenciális miRNS-célok azonosítása
- A HSC-k izolálása, tenyésztése és azonosítása
- MiR-146a-5p transzfekció HSC-be
- RNS interferencia és transzfekció
- Immunocitokémiai elemzés.
- Sejtproliferációs vizsgálat
- Western Blot elemzés
- Luciferáz aktivitás vizsgálata
- statisztikai elemzés
- további információ
- Kiegészítő információk
- PDF fájlok
- Kiegészítő információk
- Hozzászólások
Tárgyak
- Májfibrózis
- Alkoholmentes zsírmájbetegség
Összegzés
Bevezetés
Az alkoholmentes steatohepatitis (NASH) a nem alkoholos zsírmájbetegség (NAFLD) része, amelyet steatosis, lobularis gyulladás és progresszív pericelluláris fibrózis jellemez. Hosszan tartó májkárosodás esetén a steatohepatitis májfibrózissá válhat, amelyet az extracelluláris mátrix (ECM) túlzott felhalmozódása jellemez. A májstellátum sejtek (HSC) központi szerepet játszanak a májfibrózis 2 patogenezisében. Az inaktív HSC-k a krónikus steatohepatitis 3 hatására aktiválódhatnak. Az aktivált HSC-k serkentik a kollagéntermelést és az ECM felhalmozódását, ami a májfibrózis megjelenését eredményezi 4. A fibrózisos alkoholmentes steatohepatitis patofiziológiájának megértésében elért alapvető eredmények ellenére a fibrogenezis mechanizmusai steatohepatitis jelenlétében továbbra is megfoghatatlanok.
Eredmények
A máj miRNS-ek differenciális expressziója fibrózisos steatohepatitisben szenvedő egerekben
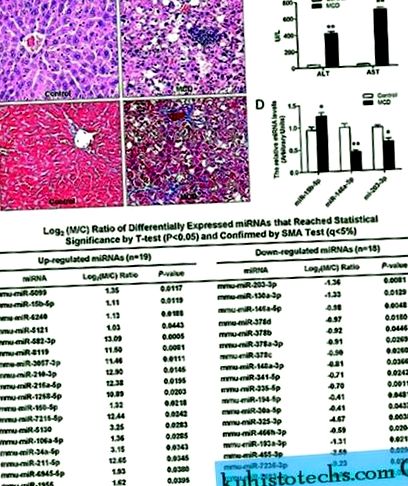
Amint az 1. ábrán látható, az MCD diétával táplált egerek májszakaszai rendezetlen lebenyszerkezetet, makrosteatózist mutattak ki a 3. zónában, pont- vagy gócos hepatocyta nekrózist, gyulladásos beszivárgást és perisinusoidális fibrózist (1A. Ábra), amelyhez szignifikánsan magasabb szérum társult. ALT és AST szint (P kétszer) (1C. Ábra).
( NAK NEK ) A máj metszetének hisztopatológiai változásai az étrendet tápláló egerekben és az MCD kontrollja. Hematoxilin és eozin festett (felül) és Masson trichromatism festett (alul). ( B ) Az MCD diéta hatása a szérum ALT és AST szintre. ( C ) Differenciálisan szabályozott miRNS-ek, a miRNS mikro-sugarak által azonosítva. ( D ) A mikroarray adatok validálása valós idejű RT-PCR segítségével. A vizsgálatokat három példányban hajtottuk végre minden RNS-minta esetében, és az egyes miRNS-ek relatív mennyiségét U6 snRNS-re normalizáltuk. Az értékek átlag ± SD, ** P
( NAK NEK ) GO kategória elemzés, az összes differenciálisan szabályozott miRNS előre jelzett célpontjain alapulva. A függőleges tengely a GO kategóriát, a vízszintes tengely pedig a GO dúsítást jelöli. ( B ) Útelemzés differenciálisan szabályozott miRNS-ekhez. Csak a P jelzésű útvonalak jelennek meg
( NAK NEK ) Reprezentatív morfológiai képek és nyugvó és aktivált HSC-k immunszöveti kémiai festése a desmin és az α-SMA esetében (400 ×). ( B ) a miR-146a-5p expresszióját valós idejű qRT-PCR-rel vizsgáltuk. Az értékek átlag ± SD, ** P # P
( NAK NEK ) Az LX-2 és HSC-T6 sejtek szaporodását jelző desmin festés csökken, ha a miR-146a-5p túlzottan expresszálódik. ( B ) miR-146a-5p gátolta az LX-2 és HSC-T6 sejtek növekedését a CCK-8 vizsgálatokkal meghatározva. Az értékek átlag ± SD, * P
( NAK NEK, C ) a miR-146a-5p lehetséges kötőhelyei a Wnt1 és Wnt5a 3'UTR-jében. ( B, D ) A HEK-293T sejteket a Wnt1 és Wnt5a vad típusú vagy mutáns 3'UTR formáját tartalmazó luciferáz riporter vektorral transzfektáltuk miR-146a-5p utánzások, utánzó kontroll, miR-146a-5p inhibitor és inhibitor kontroll jelenlétében, majd a transzfekció után 48 órával értékeltük a luciferáz riporter aktivitását. Az értékek átlag ± SD, * P # P # P ## P
( NAK NEK ) mRNS és fehérje szintek ( B ) Mβ-diétán és kontrollon májat tápláló egerekben β-katenin, GSK-3β és NFAT5. ( C ) A HSC-T6-ot miR-146a-5p inhibitorral vagy inhibitor kontrollal, miR-146a-5p-vel utánoztuk vagy utánoztuk 48 órán keresztül. Az mRNS és a fehérje szintje ( D ) β-katenin, GSK-3β és NFAT5 analízist valós idejű RT-PCR-rel és Western-blot-analízissel végeztük. A Β-aktint használtuk terhelés kontrollként. Az értékek átlag ± SD, ** P
Összegzésként megállapítottuk a máj miRNS-eket, és mikrosávcsövek segítségével értékeltük expressziós mintázatukat az MCD diéta által kiváltott alkoholmentes fibrosizáló steatohepatitisben. Az validált miRNS-ek közül a miR-146a-5p szignifikáns lefelé szabályozott volt az alkoholmentes fibrosizáló steatohepatitisben és az aktivált HSC-kben. A miR-146a-5p túlzott expressziója hozzájárult a májfibrózis kialakulásához azáltal, hogy gátolta a proliferációt, a HSC aktivációt és a kollagén lerakódást, elnyomva a Wnt jelátviteli utat. Ezért a miR-146a-5p új szabályozóként szolgálhat az alkoholmentes fibrózus steatohepatitis patogenezisében.
Mód
Alkoholmentes szálas steatohepatitis állatmodelljei
Nyolc hetes hím C57BL/6J egereket tenyésztettek és elhelyeztek a korábban leírtak szerint. A nem alkoholos fibrózus steatohepatitist úgy indukálták, hogy az egereket 8 hétig MCD-diétával (Research diets, Inc., NJ, New Brunswick, USA) táplálták. Eközben az egereket kolin-bitartáttal és DL-metioninnal (Research diets, Inc., NJ, New Brunswick, USA) kiegészített étrenddel etették kontrollként. A kísérlet végén az összes állatot altatásban feláldoztuk, és biokémiai analízishez vérmintákat gyűjtöttünk a femoralis artériából. A májokat szövettani analízishez részben 10% -os formalinban rögzítettük, vagy lipid-nitrogénben lefagyasztottuk, majd -80 ° C-on tároltuk a fagyasztóban, amíg szükséges volt. Minden protokollt és eljárást a laboratóriumi állatok gondozásával és felhasználásával foglalkozó Hebei Bizottság útmutatásait követve hajtottak végre, és a Hebei Orvostudományi Egyetem állatkísérleti etikai bizottsága jóváhagyta.
Szövettani és biokémiai elemzés.
A paraffinba ágyazott máj hematoxilinnal és eozinnal festett és Masson trichromatizmussal (5 μm vastagsággal) festett szakaszait máj steatosisra, gyulladásra és fibrózisra pontozták, amelyet korábban Brunt kritériumai és a NAFLD szövettani pontozási rendszere szerint írtak le a Patológiai Bizottság a nem alkoholos steatohepatitis klinikai kutatási hálózatának. Az ALT és az AST szérumszintjét enzimatikus kinetikai módszerrel mértük automatikus biokémiai analizátorral (Olympus AU2700, Japán) a gyártó utasításainak megfelelően.
MicroRNS Microarray Assay
A teljes RNS-t kivontuk 20 mg májszövetből az egerekből, akiket MCD-diétával tápláltak, és az egereket a kontroll-diétával (n = 3 egér/csoport) táplálták TRIzol-reagens (Invitrogen) alkalmazásával a gyártó utasításai szerint. A µParaflo ™ mikro RNS microarray tesztet szolgáltató (LC Sciences, Houston, TX, USA) segítségével végeztük. A vizsgálat 4-8 ug teljes RNS-mintából indult, amelyet poli (A) farokkal 3 'meghosszabbítottunk poli (A) polimeráz alkalmazásával. Ezután egy oligonukleotid jelölést csatoltunk a poli (A) farokhoz a későbbi fluoreszcens festékfestéshez. A hibridizációt egy éjszakán át egy µParaflo mikrofluid chipen végeztük mikrocirkulációs szivattyúval (Atactic Technologies). Az RNS hibridizáció után a jelöléssel konjugált Cy3 festéket a mikrofluid chipen keresztül futtattuk a festék festésére. A fluoreszcencia képeket lézerszkennerrel (GenePix 4000B, Molecular Device) gyűjtöttük össze, és az Array-Pro képelemző szoftverrel (Media Cybernetics) digitalizáltuk. Az adatokat úgy elemeztük, hogy először kivontuk a hátteret, majd normalizáltuk a jeleket egy LOW szűrővel (lokálisan súlyozott regresszió).
QRT-PCR elemzés
A teljes RNS-t izoláltuk és fagyasztott májszövetekből TRIzol reagenssel (Invitrogen) extraháltuk. A cDNS-t miRNS-specifikus szár hurok primer reverz transzkriptáz (RiboBio, Guangzhou, Kína) vagy oligo dT primerek (Thermo, Waltham, MA, USA) felhasználásával szintetizáltuk. Differenciálisan a qRT-PCR-t egy ABI 7500 Real-Time PCR rendszeren (Applied Biosystems, Foster City, CA, USA) végeztük SYBR Green Master Mix alkalmazásával (CoWin Biotech, Peking, Kína). A miRNS relatív bőségét U6 kis mag RNS-re normalizáltuk, és a génexpressziós szinteket normalizáltuk egy endogén glükeraldehid-foszfát-dehidrogenáz (GAPDH) referenciagénnel szemben. Az egyes miRNS-ek és gének relatív mennyiségét 2 -ΔΔCt módszerrel mértük. Az összes qRT-PCR reakciót három példányban hajtottuk végre. A qRT-PCR-hez használt primereket az 1. táblázat mutatja.
Teljes méretű asztal
A potenciális miRNS-célok azonosítása
RNS interferencia és transzfekció
A HSC-T6 sejteket a Wnt1 elleni siRNS-sel vagy a Wnt5a elleni siRNS-sel transzfektáltuk, és a kontroll siRNS-t (Ribo Bio, Guangzhou, Kína) kódolt szekvenciából áll, amely nem vezet egyetlen celluláris üzenet specifikus lebomlásához sem. A SiRNS-eket lipofektamin 2000 (Invitrogen) alkalmazásával HSC-T6 sejtekbe transzfektáltuk. Az eltávolítás hatékonyságát qRT-PCR és Western blot alkalmazásával értékeltük. A szintetizált oligókat az 1. táblázat mutatja
Immunocitokémiai elemzés.
A HSC-ket kamrai tárgylemezeken tenyésztettük, és transzfekciós kísérleteket hajtottunk végre a fent leírtak szerint. A sejteket 4% paraformaldehidben rögzítettük 15 percig, majd háromszor PBS-sel mostuk. A sejteket X-Triton100-tal 20 percig áztattuk, és háromszor PBS-sel mostuk. A sejteket ezután 5% szarvasmarha-szérum albuminnal PBS-ben blokkoltuk 1 órán át, majd inkubálást végeztünk dezmin (ProteinTech Group, Chicago, USA) és α-SMA (Novus Biologicals, Littleton, USA) és USA ellen 16 éven keresztül. h 4 ° C-on egy éjszakán át. Háromszor PBS-sel végzett mosás után a másodlagos antitestet felvittük és 1 órán át inkubáltuk. További mosás után a sejteket fluoreszcens mikroszkóppal elemeztük.
Sejtproliferációs vizsgálat
Öt órával a miR-146a-5p utánzóval vagy utánzó kontrollal végzett transzfekció után az LX-2 és HSC-T6 sejteket újra beültettük 96 lyukú lemezekre, 5 × 103 sejt/lyuk sűrűségben 1, 2, 3, 4, 5d. A sejtek szaporodását a gyártó utasításainak megfelelően a Cell Counting Kit-8 (CCK-8, Dojindo, Kumamoto, Japán) alkalmazásával vizsgáltuk. A kísérleteket háromszor, egymástól függetlenül hajtottuk végre.
Western Blot elemzés
Az összes fehérjét kivontuk a májszövetből és a sejtekből radioimmunprecipitációs puffer (RIPA) alkalmazásával. 80 ug mintafehérjét elválasztottunk 10 vagy 12% SDS-PAGE gélen, és elektrodepozícióval PVDF membránokra (Millipore Corporation, Billerica, MA, USA) vittük át. A membránokat 60 percig blokkoltuk 0,1% Tween-20 és 5% tejet tartalmazó pufferben. A membránokat egy éjszakán át 4 ° C-on inkubáltuk α-SMA, Col-1, MMP-2 (Bioss, Peking, Kína), Smad7 (Novus Biologicals, Littleton, USA), Wnt1 (Abcam, Cambridge, MA, USA) ellen. USA), Wnt5a (Novus Biologicals, Littleton, USA), Β-katenin, GSK-3β (ProteinTech Group, Chicago, USA), NFAT5 (Santa Cruz, Kalifornia, USA). Az immunkomplexeket torma-peroxidázzal (HRP) konjugált szekunder antitestekkel (ProteinTech Group, Chicago, USA) detektáltuk, majd ECL-módszerrel vizualizáltuk. A Β-aktin (Boster, Wuhan, Kína) töltésellenőrzésként szolgált. Az egyes érdekes fehérjetsávok intenzitását denzitometriával számszerűsítettük a Quantity One 4.6.3 szoftver (Bio Rad) alkalmazásával.
Luciferáz aktivitás vizsgálata
A Wnt1 és Wnt5a vad típusú (WT) vagy mutáns (Mut) magrégióval rendelkező szegmensek szekvenciáját szintetizáltuk és klónoztuk a psiCHECK TM -2 luciferáz vektorban (Promega, Madison, WI, USA). A Xho I és Not I korlátozó helyek. Egy üres luciferáz riportervektort használtunk negatív kontrollként. A HEK-293T sejteket 24 lyukú lemezeken tenyésztettük, és mindegyik lyukat 200 ng megfelelő psi-CHECK2 3'UTR konstrukcióval transzfektáltuk, a miR-146a-5p 50 nM utánzó vagy utánzó kontrollt és az inhibitor kontrollt vagy 100 nM inhibitorok, Lipofectamine 2000 transzfekciós reagens (Invitrogen, Carlsbad, CA) alkalmazásával, a gyártó protokollja szerint. 5 óra elteltével az OptiMEM transzfekciós táptalajt (Invitrogen, CA, USA) DMEM-re cseréltük. A sejteket összegyűjtöttük és a transzfekció után 48 órával elemeztük a luciferáz assay rendszer (Promega) alkalmazásával. A szintetizált oligókat az 1. táblázat mutatja.
statisztikai elemzés
Az adatokat átlag ± szórásként fejezzük ki. A statisztikai elemzést az SPSS 17.0 alkalmazásával végeztük. A statisztikai elemzéshez egyirányú varianciaanalízist (ANOVA) és Student-tesztet használtunk. Úgy ítélték meg, hogy P
- Cél, hogy az energiát égető zsírsejtekben meggyulladjon a hő
- Természetes gyilkos sejtpopulációk és citotoxikus aktivitás tejjel etetett sertésekben
- Mike Tyson radikális fizikai titkai megváltoztatják a drága őssejt-kezelést
- Az elhízás fedezze fel, hogy az immunsejtek metabolizmusa hogyan szabályozza a TN súlyát
- Miért olyan halálos a hasnyálmirigyrák?