Összegzés
Hozzáférést a
Bevezetés
Teljes méretű kép
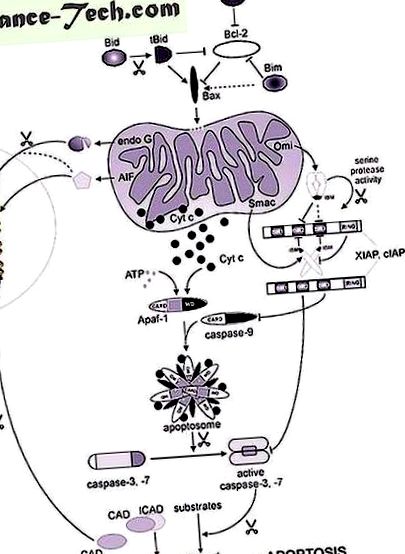
Először leírjuk a citokróm c-t, az első mitokondriális fehérjét, amely apoptotikus körülmények között a mitokondriumokból került ki. A citokróm c kaszpasz kaszkádot generál az apoptózis képződésének elősegítésével, mindaddig, amíg az apoptotikus proteáz-aktiváló 1-es faktor (Apaf-1) expresszálódik. Ezután a G endonukleázra és az apoptózist indukáló faktorra (AIF) összpontosítunk, amelyek mind hozzájárulnak a nukleáris DNS lebontásához. Az apoptotikus DNS károsodásához való hozzájárulását az apoptotikus sejtpusztulás során aktív egyéb nem mitokondriális nukleázok létezésének összefüggésében tárgyalják. A citokróm c mellett egyéb mitokondriális tényezők, például Smac/DIABLO és HtrA2/OMI is hozzájárulhatnak a kaszpáz aktiválásához, akár közvetett módon. A Smac/DIABLO és a HtrA2/OMI antagonizálja az apoptózis fehérjék (IAP) inhibitorát, a sejtes kaszpáz inhibitorok családját. A Smac és a HtrA2/OMI azonban kaszpáztól független sejthalált is okoz, még ismeretlen mechanizmusok révén.
Citokróm c
A nukleáris kromatin kondenzáció és a DNS fragmentáció mitokondriális mediátorai.
G endonukleáz
Apoptózis indukáló faktor
A megfelelő AIF homológok felszabadulása a mitokondriumokból és azok transzlokációja a sejtmagba a Dictyostelium discoideum és a fonálféreg C. elegans konzervált (Arnoult et al., 2001; Wang et al., 2002). Megjegyzendő, hogy az AIF fonálféreg-ortológusa, a WAH-1 expressziójának csökkentése csak késlelteti a programozott fonálféreg-sejtek pusztulását (PCD). Nem világos, hogy az AIF kölcsönhatásba lép-e és stimulálja-e az endonukleáz G aktivitását emlősökben, ahogy ez a C. elegans társaival van. .
Az AIF-rel (AMID) és a p53-érzékeny 3-as génnel (PRG3) homológ mitokondriális asszociált sejthalál-induktor az AIF-hez kapcsolódik (Ohiro és mtsai, 2002; Wu és mtsai, 2002). Az AMID egy AIF homológ flavoprotein, amelyről feltételezik, hogy a WMO-hoz kapcsolódik. Az AMID túlzott expressziója a 293T sejtekben apoptotikus sejthalált vált ki, amelyet a Bcl-2, CrmA vagy a zVAD-fmk nem tudott gátolni. A PRG3 a citoplazmában található, és feltételezett oxidoreduktáz-aktivitása apoptotikus funkciója miatt elosztható. Az AMID vagy a PRG3 által kiváltott sejthalál molekuláris hatásmechanizmusa nem világos.
A kaszpáztól és a G endonukleáztól függetlenül ható AIF kaszpázfüggő felszabadulása?
Smac/DIABLO és HtrA2/OMI: nem csak IAP antagonisták
Teljes méretű asztal
A $ config [ads_text16] nem található
Teljes méretű kép
Smac/DIABLO
Az a mechanizmus, amellyel a Smac/DIABLO kötődik az XIAP BIR2 doménjéhez, nem világos, bár ehhez szükséges az IBM és a dimer Smac/DIABLO (Wu et al., 2000; Chai et al., 2001). Ezzel szemben az aktív kaszpáz-3 és -7 interakciója az XIAP BIR2 doménjével nem jár szabad N-terminállal vagy IBM-lel. Hogyan tudja a Smac/DIABLO enyhíteni az XIAP által közvetített kaszpáz-3 és -7 gátlást? Úgy tűnik, hogy a válasz a dimer struktúrában rejlik, ezért a Smac/DIABLO kétértékű jellege és több BIR domén jelenléte az XIAP-ban. In vitro kaszpázaktivitást és kötési vizsgálatokat használva Huang és mtsai. (2003) nemrégiben kimutatta, hogy a Smac/DIABLO dimerként lép kölcsönhatásba egy XIAP molekulával, egyidejűleg kötve a BIR2 és BIR3 doméneket. Ez a kölcsönhatás a szubnanomoláris disszociációs állandóval (KD) történik, míg a Smac/DIABLO kölcsönhatása az XIAP BIR2 vagy BIR3 doménjével egyedileg történik a mikromoláris KD-vel. Ez jó példa az aviditásra, a két molekula közötti kötőerőre, amelyet két vagy több interakciós hely határoz meg. Ez az XIAP iránti erős affinitás lehetővé teszi a Smac/DIABLO számára, hogy in vitro kiszorítsa a kaszpáz-7-et (és a kaszpáz-9-et) az XIAP-ból, megkönnyítve azok aktivációját.
Az IAP-k azonban képesek harcolni a Smac/DIABLO ellen, hogy fenntartsák az antiapoptotikus állapotot a sejtben. Az XIAP-ben, a cIAP1-ben és a cIAP2-ben jelenlévő RING doménről beszámoltak arról, hogy ubiquitin-protein ligáz aktivitással rendelkezik, és hozzájárulhat az IAP-k antiapoptotikus működéséhez azáltal, hogy Smac/DIABLO-t célozza meg a proteasoma által közvetített lebontásra (MacFarlane et al., 2002; Hu és Yang, 2003). A timocitákban ez a tevékenység az IAP-k ellen hat, mivel a cIAP1 és XIAP glükokortikoidokkal vagy etopoziddal történő kezelésre adott válaszként önmagáról ubiquitinálódott és lebomlott (Yang et al., 2000). A Smac3, a Smac toldási variánsa, amely a mitokondriumokat is megcélozza, tartalmaz egy IBM-t, és apoptotikus ingerekre válaszul a citoszolba kerül. A közelmúltban kimutatták, hogy kötődik az XIAP-hoz és elősegíti az XIAP ubiquitinációját (Fu et al., 2003).
Ezzel az elegáns Smac/DIABLO-IAP-val ellentétben az antagonizmus a Smac β proapoptotikus jellege, a Smac olyan kötési változata, amelyből hiányzik a mitokondriális célzási szekvencia, és nem kötődik az IAP-hoz, de érzékenyíti a ligandum által kiváltott halál apoptózisát és kémiai ingereket. (Roberts et al., 2001). A Smac β proapoptotikus funkcióját a C-terminális doménje hajtja végre. A Smac/DIABLO fiziológiai mitokondriális funkciója ismeretlen, és a Diablo -/- egerek látszólag normálisak. Bár a Diablo -/- sejtlizátumok a citokróm c hozzáadása után nem mutattak kaszpáz-3 feldolgozást, az egerek és a Diablo -/- sejtek normálisan reagáltak az apoptotikus ingerekre (Okada et al., 2002). Ez a megfigyelés arra utal, hogy léteznek redundáns tényezők, amelyek kompenzálják a Smac/DIABLO, esetleg HtrA2/OMI elvesztését (lásd alább), vagy hogy a Smac/DIABLO nem játszik alapvető és általános szerepet az apoptózisban a fejlődés során.
HtrA2/IMO
A nukleárisan kódolt HtrA2/OMI-t 50 kDa-os prekurzor fehérjeként fejezzük ki, amelynek N-terminális MLS-je van, amelyet a mitokondriális behozatal során eltávolítanak, majd ezt követi a transzmembrán domént tartalmazó második vezetőszekvencia. Ennek a második vezetőnek a feldolgozása, amely a HtrA2/OMI csoport alcsoportjában fordul elő, egy IBM-t tesz ki és 35 kDa érett HtrA2/OMI-t generál (Suzuki és mtsai, 2001a; Hegde és mtsai, 2002; Martins és mtsai, 2002; van Loo és mtsai, 2002b; Verhagen és mtsai, 2002). Mivel az mnd2 egerekben a katalitikusan inaktív HtrA2/OMI feldolgozása megfelelő, a HtrA2/OMI érését valószínűleg más mitokondriális proteázok katalizálják (Jones és mtsai, 2003).
Noha a HtrA2/OMI hiányos egerek még nem állnak rendelkezésre, RNAi kísérletek szerint a HtrA2/OMI hozzájárulása az apoptózishoz javasolt, mivel a Fas, TRAIL, staurosporine vagy UV által kiváltott sejthalál jelentősen csökken (Hegde et al., 2002; Martins és mtsai., 2002). Ezzel szemben a károsodott HtrA2/OMI katalitikus aktivitásnak tulajdonított mnd2 fenotípust az apoptotikus kiváltók iránti fokozott érzékenység jellemzi (Jones és mtsai, 2003). Mivel a HtrA2/OMI expressziójának vagy aktivitásának szintjének csökkentése befolyásolja mind a mitokondriális funkcióját, mind a sejtpusztulásban betöltött citoszolos szerepét, lehetetlen határozott következtetéseket levonni a HtrA2/OMI halálhoz való pontos hozzájárulásáról. nem kapcsolható össze, például mutációs beavatkozással.
Egyéb mitokondriális tényezők
Következtetések
A hála kifejezése
Köszönjük Amin Bredan szerkesztői segítségét. Ezt a munkát az Interuniversitaire Attractiepolen (IUAP-V), a Fonds voor Wetenschappelijk Onderzoek-Vlaanderen (31.5189.00 és 3G.0006.01 támogatás) és az EC-RTD (Grant QLRT-CT-1999-00739), Genti Egyetem támogatta. az EU-projekt (011C0300) és a GOA-projekt (12050502) társfinanszírozása. Az X Saelens-t a „Biotech Fonds” és a GOA projekt (12050502), L Vande Walle és N Festjens az IWT, M van Gurp a „Centrum voor Gezwelziekten” támogatásával támogatja, G van Loo-t kifizették írta: El IUAP-V.
- 2021 nyolc legjobb fehérje- és hidratációs turmixja - fehérje turmixok
- Legjobb protein shake 2021 A 7 legjobb összehasonlítása
- A 2021-es hét legjobb tiszta tejsavófehérje-shake - fehérje turmixok
- Fehérjék vegetáriánusoknak Teljes lista 【2021】
- 2021 nyolc legjobb gyümölcs- és fehérje-shake - fehérje turmixok