- Tárgyak
- Összegzés
- Bevezetés
- Mód
- Kémiai termékek
- Állatok
- Aorta érrendszeri reaktivitási vizsgálat
- Mesenterialis érrendszeri reaktivitási vizsgálat
- Sejtkultúra
- Western blottolás
- Szövettan
- Statisztika
- Eredmények
- A PVAT hatása az aorta reaktivitására
- A PVAT hatása a mesenterialis artéria reaktivitására
- A HFD csökkenti az eNOS aktivitást
- Aorták és PVAT átalakítása patkányokban HFD-ben
- AMPK és mTOR expresszió patkány aortákban HFD-ben
- A PVAT hatása az AMPK/mTOR expressziójára tenyésztett VSMC-ben
- Vita
Tárgyak
- Sejtjelzés
- Zsírok
- Elhízottság
- Érbetegségek
Összegzés
Mód
Kémiai termékek
A fenilefrint (PE), az acetilkolint (ACh) és a nitroglicerint (NTG) a Sigma-Aldrich-től (Taufkirchen, Németország) vásároltuk.
Állatok
6-8 hetes hím Wistar patkányokat a Charles River-től (Sulzfeld, Németország) szereztünk be. A patkányokat 12/12 órás nappali/éjszakai körülmények között helyeztük el, és minden állatnak ad libitum táplálékot és vizet adtunk. A helyi állatgondozási és -használati bizottság jóváhagyta az összes állatgondozási és -használati eljárást. A kutatás megfelel az Egyesült Államok Nemzeti Egészségügyi Intézete által kiadott, a laboratóriumi állatok gondozására és felhasználására vonatkozó útmutatónak (NIH, 85–23. Kiadvány, felülvizsgált 1996). Az állatok standard táplálék-étrendet kaptak (kontrollcsoport, n = 18) vagy HFD-t (HFD-csoport, n = 18) 6 hónapig.
Aorta érrendszeri reaktivitási vizsgálat
Mesenterialis érrendszeri reaktivitási vizsgálat
Sejtkultúra
A VSMC-t patkány mellkasi aortákból nyertük, és szöveti explantációs módszerrel tenyésztettük, amint azt csoportunk korábban leírta. 27 perivaszkuláris adipocitát nyertünk periaorta zsírszövetből, és tenyésztettük a fent leírt szöveti explantációs módszerrel. 28 VSMC/adipocita kokultúrát hoztak létre 10 μM C vegyület, egy AMPK inhibitor (Calbiochem, San Diego, CA, USA) jelenlétében vagy hiányában, amint azt korábban a porózus polietilén-tereftalát tenyész műanyag betétjeinek ellentétes oldalán leírták. hatékony tenyésztési terület 0,3 cm 2, pórusméret 0,4 μm és pórus sűrűség 1 × 108/cm 2 (Becton Dickinson, Franklin Lakes, NJ, USA).
Western blottolás
Szövettan
Az aorta tunica vastagságát bevett módszerekkel határoztuk meg. Az aorta szövetet 10% formaldehid/foszfátpufferolt sóoldatban rögzítettük és paraffinba ágyazottuk. A rutinszerű szövettani eljárások után az első bordaközi artéria közeli keresztmetszeteket Victoria Blue és Ponceau S festékkel festették és × 200 nagyítással tanulmányozták. A képeket digitális fényképezőgéppel készítettük Nikon TE2000 mikroszkóp segítségével (Nikon Corporation, Tokió, Japán). A tunica táptalajt a belső és a külső rugalmas lamina közötti régióként határoztuk meg, amelyet az artériás szakaszok négy ortogonális pontján mértünk állatonként három egymást követő aorta gyűrű során a NIS-Elements 3.0 (Nikon Corporation) képalkotó szoftverrel.
A periaorta adipocita méretét a korábban leírtak szerint mértük. Hat patkányból 30 periaorta zsírszövetet gyűjtöttünk be, 10% -os pufferolt formalinnal rögzítettünk, paraffinba ágyazottuk, és hematoxilinnel és eozinnal festettük. A képeket Nikon TE2000 mikroszkóppal (Nikon Corporation) rögzítettük, és az egyes patkányokból kivont összesen 100 adipocita területét a NIS-Elements 3.0 képalkotó szoftver (Nikon Corporation) segítségével határoztuk meg.
Statisztika
Az adatok átlag ± szem. A fele maximális hatékony agonista koncentrációt (EC50) és a maximális választ (E max) az egyes agonista koncentráció-válasz görbékből számoltuk, a GraphPad Prism 3.0 (San Diego, CA, USA) alkalmazásával. Az átlagértékek statisztikai különbségeit adott esetben Student-féle t-teszt vagy egyirányú varianciaanalízissel Bonferroni többszörös összehasonlító post hoc tesztekkel értékeltük. A 0,05 alatti kétoldalas P-értékeket statisztikailag szignifikánsnak tekintettük.
Eredmények
A PVAT hatása az aorta reaktivitására
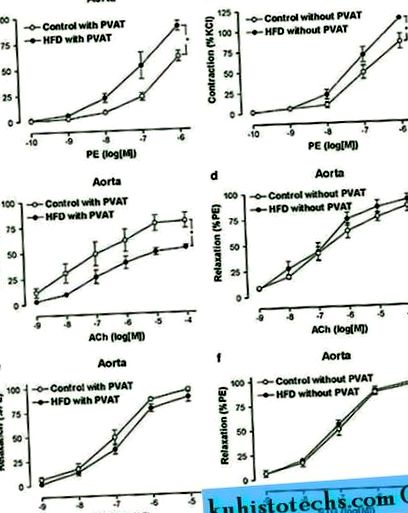
A táplált táplálékkal rendelkező patkányokhoz képest a testtömeg és a zsírszövet tömeg 6 hónapig jelentősen megnőtt HFD-vel rendelkező patkányokban (1. táblázat). A farok mandzsetta szisztolés vérnyomása azonban nem különbözött két csoport között (127 ± 4 Hg HFD-ben és 123 ± 5 Hgmm a Chow-étrendben, P> 0,05). Az aortagyűrűk PE által kiváltott kontraktilis válasza jelentősen megnőtt a HFD-vel táplált patkányokban, különösen PVAT jelenlétében (1a. És b. Ábra) (2. táblázat). Ezenkívül az endothelium-függő relaxáció szignifikánsan csökkent HFD-vel rendelkező patkányokban az étkezési táplálékkal csak PVAT jelenlétében (1c. És d. Ábra) (2. táblázat). Az endothelium független relaxációját azonban nem befolyásolta patkányokban PVAT jelenléte vagy hiánya sem Chow-étrenden, sem DCA-n (1e. És f. Ábra) (2. táblázat).
Teljes méretű asztal
A PVAT hatása az aorta reaktivitására. PE okozta zsugorodás ( nak nek, b ) és az ACh vagy az NTG ( c - F ) frissen izolált aortagyűrűkben PVAT-tal vagy anélkül, patkányokból, akiket kontroll és magas zsírtartalmú étrendre (HFD) tettek. Az eredmények csoportonként 6-8 patkány 6-8 gyűrűjének átlag ± semme. * P
A PVAT hatása a mesenterialis artéria reaktivitására. PE okozta zsugorodás ( nak nek, b ) és az ACh- ( c, d ) vagy NTG ( és, F ) frissen izolált mesenterialis artériás gyűrűkben értékelték, periaorta zsírszövetük jelenlétében vagy hiányában. Az eredmények csoportonként 5-10 patkány 5-10 gyűrűjének átlagai ± fél; * P
ENOS expresszió és foszforiláció az aortában. Chow- (kontroll) vagy HFD-vel táplált patkányok aorta szövetében a teljes eNOS-t és a p-eNOS Ser1777-et Western-blot-módszerrel detektáltuk. Az oszlopdiagramok a kontrollcsoportra normalizált relatív foszforilezést mutatják. Az eredmények 4–8 patkány 4–8 független kísérletének átlagai ± félév. ** P 2, illetve P
Az aorta és a PVAT átalakítása patkányokban HFD-ben. ( nak nek ) A képek Victoria-kékkel és Ponceau S-vel festett aorták keresztmetszetét mutatják az egyes patkánycsoportokból. Bal oldali panel, vezérlőcsoport; jobb panel, HFD csoport. A skála sávja 100 um; nagyítás, × 200. ( b ) A grafikon a tunika táptalaj vastagságának számszerűsítését mutatja. Az eredmények átlag ± sem (n = 3 patkány csoportonként). ** P ** P 31 Az AMPK expressziója és a foszforiláció patkány aortákban HFD-n szignifikánsan csökkent az étkezési étrendhez képest (5a. Ábra). Amint azt a reprezentatív sávokban bemutattuk, a teljes és foszforilált mTOR szintje szignifikánsan nőtt a HFD adagolással (5b. Ábra). A foszforilezett mTOR és az összes mTOR aránya azonban nem változott (5b. Ábra). Továbbá a PI3K és Akt fehérje expressziója és az aortában a foszforiláció hasonló volt a két csoportban (5c. És d. Ábra).
AMPK, mTOR, PI3K és Akt fehérjék expressziója és foszforilációja az aorta szövetben. AMPK/p-AMPK Thr172 ( nak nek ), mTOR/p-mTOR Ser2448 ( b ), PI3K/p-PI3K ( c ) és Akt/p-Akt ( d ) chow- (kontroll) vagy HFD-vel táplált aorta szövetben. A patkányokat Western-blot segítségével detektáltuk. Az oszlopdiagramok a relatív foszforilezést mutatják a kontrollcsoportra normalizálva. Az eredmények 4–8 patkány 4–8 független kísérletének átlagai ± félév. ** P
Habár spontán hipertóniás patkányokban beszámoltak a perivaszkuláris zsír mesenterialis arteriolákra gyakorolt kontraktív hatásának csökkenéséről, 5 tanulmány vizsgálta a PVAT szerepét az elhízásban. Ez a tanulmány először mutatja, hogy a PVAT jelenléte károsítja a relaxációt mind a vezető artéria, mind a kis arteriolákban HFD-indukálta elhízott patkányokban. Ezenkívül a HFD-ben lévő elhízott patkányok PVAT-jában nagyobb adipociták és vastagabb aorta tunica található. Ezen új megállapítások alapján úgy döntöttünk, hogy megvizsgáljuk a mögöttes mechanizmusokat.
Az AMPK az összes eukariótákban jelen lévő metabolit-érzékelő protein-kináz-család tagja, és úgy gondolják, hogy az energiaállapotra vagy a tápanyagok elérhetőségére reagálva szabályozza a sejtek proliferációját. Az mTOR, egy evolúciósan konzervált szerin/treonin kináz, a tápanyag és a mitogén szignálokat integrálja a sejtnövekedés és a sejtosztódás szabályozására a fehérje transzláció/szintézis révén. Az AMPK aktiválása elnyomja az mTOR jelátvitelt és növeli a TSC1-TSC2 komplex aktivitását. Ezek a megállapítások arra utalnak, hogy az AMPK aktivációja gátolja az mTOR aktivitását a fehérjeszintézis korlátozása érdekében. Az NO kritikus szerepet játszik a vaszkuláris relaxáció modulálásában, és az NO termeléséért felelős enzim, az eNOS aktivitását számos protein kináz szabályozza, beleértve az AMPK-t is. 21 AMPK szükséges az NOS adiponektin, trombin és hisztamin által kiváltott foszforilezéséhez és az ezt követő endotheliális NO termeléshez. huszonegy
A jelenlegi eredmények azt mutatják, hogy a HFD által kiváltott elhízott patkányok aortáiban az AMPK és a p-eNOS szintje alacsonyabb szintű, míg az mTOR expresszió fokozott. Továbbá a tenyésztett VSMC PVAT-tal történő inkubálása csökkenti az AMPK expressziót és növeli az mTOR expressziót. Eredményeink alátámasztják azt a felfogást, hogy a kóros AMPK/mTOR jelátviteli út felelős lehet a HFD által kiváltott érrendszeri diszfunkcióért és elhízott patkányok átalakulásáért. Ezenkívül a C vegyület gátló hatása az mTOR foszforiláció tenyésztés által indukált növekedésére tovább erősítette, hogy az mTOR-ot PVAT szabályozza AMPK-aktivációval.
Az a kórélettani mechanizmus, amellyel a PVAT közvetítheti az érrendszeri rendellenességeket és az átalakulást, nem teljesen ismert. Potenciális mediátorként az endothel diszfunkcióját elősegítő és az érrendszer átalakulásához vezető mechanizmusokban részt vevő reaktív oxigénfajok fokozott termelését javasolták potenciális mediátorként. 41 PVAT-ról beszámoltak arról, hogy pro-gyulladásos állapotot indukál HFD-indukált elhízott egerekben. A gyulladásos sejtek beszivárgása a perivaszkuláris szövetbe, és ennek következtében a gyulladásos tényezők vaszkuláris fal felé történő vándorlása szintén lehetséges mechanizmusok lehetnek, amelyek vaszkuláris diszfunkcióhoz és átalakuláshoz vezetnek.
- Körte test vagy almatest, mi határozza meg, hogy egyes területeken több zsír halmozódik fel, mint máshol
- A zsíros zsírsejtekhez kapcsolódó alacsony rézkoncentráció
- A terhesség alatt megnövekedett hasi zsír a cukorbetegséget jelentheti terhesség alatt
- Vigyázzon az étrenddel, a testnek zsírra van szüksége A Futár
- Az autó; Egyedülálló vegyes harcművészetek (MMA) P edzése; Zsírvesztés - MSN Health and