Rev Méd Chile 2007; 135: 631-635
KLINIKAI ESETEK
Ketogén étrenddel kezelt 1-es típusú glükóztranszporter-hiány szindróma (SDGLUT-1). Klinikai eset
Glükóz transzponált típus 7 hiány-szindróma (GLUT-1 SD) ketogén étrenddel kezelt. Egy eset jelentése
Verónica Cornejo E 1a, Juan Francisco Cabello A 1, Marta Colombo C 2, Erna Raimann B 1 .
1 Metabolikus betegségek laboratóriuma, Táplálkozási és Élelmiszer-technológiai Intézet (INTA), Chilei Egyetem, 2 Metabolikus Betegségek Laboratóriuma, Van Burén Kórház, Valparaíso.
táplálkozási szakember, az emberi táplálkozás mestere
(Kulcsszavak: Agybetegségek, anyagcsere, veleszületett; 1. típusú glükózszállító; Rohamok)
ÉS n 1991, De Vivo leírta az 1-es típusú agyi glükóztranszporter (SDGLUT-1) hiányának szindrómáját (OMIM 606777), két olyan betegnél, akik epilepsziás encephalopathiában szenvedtek, amely késleltetett pszichomotoros fejlődéssel, koponya-növekedés leállításával, mikrocefáliával, koordinációs és görcsösséggel alakult ki . Ezenkívül megállapította, hogy a cerebrospinalis folyadékban (CSF) csökkent a glükóz és a laktát szintje, de nem talált hipoglikémiát 1 .
Az SDGLUT-1 autoszomális domináns öröklődéssel rendelkezik 2. A Glut-1 transzporter egy olyan glikoprotein, amely 492 aminosavból áll, és felelős a glükóz átviteléért a vér-agy gáton, amely vaszkuláris endoteliális sejtekben, asztrocitákban és neuronokban expresszálódik. A gént az 1. kromoszóma rövid karján kódolták (p34.2), és 10 exonból és 9 intronból áll. A mai napig több mint 30 mutációt írtak le. Kimutatták, hogy a Glutl és a Glut3 koncentrációk születésükkor alacsonyak, és elválasztáskor normalizálódnak, amely időszak nagyobb növekedésnek és érésnek felel meg. Egyes szerzők kimutatták, hogy ezt a glikoproteint gátolja a fenobarbitál 3 .
Az ezzel a patológiával érintett gyermek pre- és perinatális története 2 hónapos korig látszólag normális, amikor apnoe és opsoclonus típusú szemmozgások jelentkeznek, amelyek megelőzhetik az epilepsziás rohamokat. A gyermekkori rohamok klinikailag széttagoltak, az EEG multifokális kisülést mutat, és generalizált tonikot, myoclonusot, atipikus hiányt, atonikus és osztályozatlanokat írtak le. A gyakoriság lehet napi, alkalmi vagy roham nélküli 4. Ezek a rohamok nem reagálnak a görcsoldókra. Nem epilepsziás paroxizmális események, például intermittáló ataxia, mentális zavartság, letargia, álmosság, hemiparesis, rendellenes mozgások, bénulás, alvászavarok, mikrocefália vagy koponyaűri növekedés lassulása 5. .
Laboratóriumi vizsgálatokban tartós hipoglikónia (40 mg/dl alatt) figyelhető meg, a CSF-ben lévő laktát csökkenhet vagy nem (6 .
A kezelés ketogén étrenden alapul, amely keton testeken keresztül biztosítja az agy számára a szükséges energiát. A szénhidrátban gazdag természetes ételek nagy korlátozása miatt, amelyek viszont nélkülözhetetlen tápanyagok forrását jelentik, az étrendet az életkornak és a nemnek megfelelően állandóan ki kell egészíteni ásványi anyagokkal, lipo és vízoldható vitaminokkal, L-karnitin és liponsav 7-10 .
Leírjuk a chilei diagnosztizált SDGLUT-1 első esetének klinikáját, biokémiáját, molekuláris vizsgálatát és hosszú távú nyomon követését.
KLINIKAI ESET
Női beteg, nem páros szülők, releváns perinatális kórelőzmény nélkül; születési súlya 3-450 g, magassága 49,5 cm, a koponya kerülete 35,2 cm. Apgar 9, 5 perckor.
Másfél hónapos korában generalizált tónusos klónusos rohamokat mutatott be, amelyek másodpercekig tartottak, napi 20 mioklonussal fejlődtek, hajlítógörcsöket adva hozzá. Farmakológiai kezelést kapott valproinsavval, fenobarbitállal és karbamazepinnel, klinikai válasz nélkül, ami tüneti hiperammonémiás reakciót váltott ki a valproinsavval szemben.
3 és fél hónapos korban teszteket végeztek egy metabolikus betegség kizárására, 26,5 mg/dl laktacidémiát (VN: 5-15), a CSF laktát 5,6 mg/dl (VN: 10,8- 18,9 mg/dl). A piravasav a plazmában megemelkedett (1,4 mg/dl) (VN: 0,3-0,9), de a CSF-ben normális (0,43 mg/dl) (VN: 0,5-1,7) és az ammónia 85 µg/dl (35-100) volt µg/dl). Az aminosavak mennyisége a szérumban, az acilkarninek a teljes vérben, a szerves savak a vizeletben és a karnitin a szérumban normális volt.
Öt hónap múlva az elektroencefalogram (EEG) folyamatos polimorf theta-delta aktivitást detektált, amelyet korának rendellenesnek tekintettek, és a mágneses rezonancia képalkotás frontális atrófiát mutatott a subarachnoidális terek növekedésével. A pszichomotoros fejlődés késésével és a koponya növekedésének, a törzs ataxiájának és a bilaterális piramidális szindrómának lassulásával alakult ki.
7 hónaposan került az Amerikai Egyesült Államok Bostoni Gyermekkórházába, ahol 26 mg/dl CSF-glükóz csökkenést és normoglikémiát (84 mg/dl) találtak, és mindkét paraméter aránya 0, 31 (normálérték 0,65 + 0,01 felett), összhangban a hipoglikorachiával, ami SDGLUT-1-re utal.
Az eritrocitában található Glut-1 fehérje bebizonyosodott, hogy mind az immun, mind a kémiai válaszban azonos az agy kapillárisainak endotélsejtjeinek Glut-1 fehérjéjével. Emiatt a glükóz szállítása az eritrocitában összehasonlítható a glükóz transzportjával a vér-agy gáton. Ezt a megállapítást figyelembe véve kidolgozták a 3-O-metil-D glükóz technikát, amely meghatározza a glükóz eritrocita általi felvételét, amely lehetővé teszi az extrapolációt a glükóz transzportjával a vér-agy gátban 11. Esetünkben ezt a technikát alkalmaztuk, 44% -os glükózfelvételt (VN 80% -100%) elérve, megerősítve az SDGLUT-1 értéket.
A molekuláris vizsgálatban a polimeráz láncreakciót (PCR) és a restrikciós fragmens polimorfizmusainak (RFLP) 3,6 elemzését alkalmaztuk, meghatározva a Glut-gén 969., C971T deléciós csoportjának mutációját. 1. ábra (1. ábra) (Dr. D. De Vivo által végzett molekuláris vizsgálat).
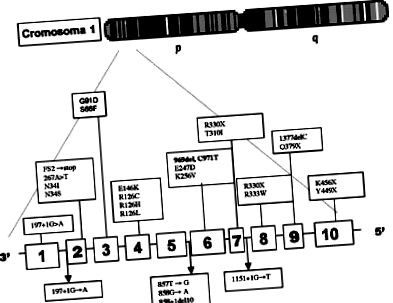 |
| 1. ábra Az SDGLUTl-t okozó azonosított mutációk. A számozott oszlopok a Glut-1 gént alkotó 10 exont és 9 intront képviselik, amelyek az 1. kromoszóma rövid karján helyezkednek el (1p34,2). A mutáció |
Az egyszeres fotonemissziós komputertomográfia (SPECT) kétoldali temporális, bal oldali parietális és thalamus hipometabolizmust mutatott.
A ketogén étrendet azonnal megkezdték, 90 kilogramm kalóriát adva kilogrammonként, 85% lipiddel, 9% fehérjével és 6% szénhidráttal, lipidek és fehérjék plusz szénhidrátok arányával 3: 1 arányban, az INTA-ban alkalmazott protokoll alapján, a Chilei Egyetem 9,10. Az étrend tiltja a szacharóz, szorbit, fruktóz és laktóz fogyasztását, ezért kalciummal (450 mg/nap), cinkkel (5 mg/nap), vitaminokkal, különösen C-vitaminnal (1 g/a sejt oxidációjának megelőzése érdekében az L-karnitin (50 mg/kg/nap) és a liponsav (200 mg/nap).
A ketogén étrend 7 napos megkezdése után a rohamok eltűntek, és együttesen megkezdődött a görcsoldók csökkenése.
Jelenleg 6 éves, a ketogén étrendet 83% lipiddel (27% -uk közepes láncú triglicerideknek felel meg) és 17% fehérjével és szénhidráttal (2,5: 1 arány) tartja fenn. A tápanyag-kiegészítés megegyezik az elején leírtakkal, életkoruk és tápláltsági állapotuk szerint alakították ki őket.
A glikémia 80-90 mg/dl, az összkoleszterin 187 mg/dl, a HDL 55 mg/dl és az LDL 121 mg/dl értéken marad. A calciuria, a kreatininuria, a biokémiai profil, a vénás gázok és a plazma elektrolitok a normál tartományon belül vannak. Az éhomi béta-hidroxi-butirát sav 2,5 µM/1, étkezés utáni 5,0 µM/l, figyelembe véve a ketogenezist, ha ez az érték 2,0 µM/1 felett van.
A neurológiai vizsgálat során a hiperaktív viselkedés kiemelkedik mentális vizsgálatában. A koponyaidegekben diszartriát és archipomimiát mutat be. A motoros vizsgálat a törzs és a végtag tónusának csökkenését mutatja, az erő vagy az izomtrofizmus veszélyeztetése nélkül. A kisagyi vizsgálatban a szándék remegése, a szinkinézis, a diszmetria és a diszkrét diszdiadokokinézis fordul elő. A járás instabil, és a támaszpont növekedése jellemzi, lateralizáció nélkül.
Intelligencia hányadosa (IQ), amelyet az óvodások Wechs-ler intelligencia tesztje (WISP) 12 értékel, az észak-amerikai normáknak megfelelően korrigált 103 IQ teljes IQ-t kapott, ami az átlagos normál tartomány felső határa. Jelentős eltérést mutat azonban a verbális és a kézi skála között, az utóbbi kárára (verbális IQ: 119, magas normál és manuális IQ: 85, lassú normál), ami sajátos nehézségeket jelent a vizuális tér szervezésében és a visomotorban.
A táplálkozási állapot normális: a testtömeg-index 15,8 kg/m 2 (VN 15 és 18 kg/m 2 között) 13, súlya (21 kg) az életkora és a magassága (1,16 m) az életkor szempontjából, mindkét paraméter a A referenciatábla 75. percentilis (Országos Egészségügyi Statisztikai Központ) 14 .
1991-től napjainkig körülbelül 100 esetet diagnosztizáltak a világon, mindezt klinikai megnyilvánulások révén 15 .
Az irodalomban leírt esetek többségének normális volt a pre- és perinatális története, és az első klinikai megnyilvánulás görcsroham volt az első 4 hónapos korban, nem reagálva a görcsoldó kezelésre. A cerebrospinalis folyadékban csökkent a glükóz és a laktát mennyisége is, egyenlő azzal, amit esetünkben észleltünk. A differenciáldiagnózist azonban kiterjesztették más klinikai tünetekre is, mivel olyan gyermekeknél írták le, akiknek csak rendellenes a szemmozgása, és akiknél kezdetben okkult neuroblasztómát gyanítottak. Ezért azt javasoljuk, hogy minden szuggesztív klinikai képpel és normális vércukorszinttel rendelkező gyermeknél értékeljék a CSF glükózértékét a GLUT-1 kizárására 3 .
Egy másik fontos pont a pozitív reakció a ketogén étrendre, amely elnyomja a rohamokat. A ketontestek az agyba jutnak a közepes láncú zsírsavak által használt monotriccarboxyl transzporteren keresztül, amelyek kizárólag a mitokondriális mátrixban metabolizálódnak acetil-CoA-vá, és ezt a szubsztrátot egyetlen agyi üzemanyaggá alakítják. A bemutatott klinikai esetben a ketogén étrendet 7 hónapos korban kezdték, és a rohamok azonnal leálltak. A mai napig fenntartja ezt a diétát, és nem mutatott újabb rohamokat 8 .
A ketogén étrendet általában refrakter epilepsziában alkalmazzák, ami azt mutatja, hogy természetes görcsoldóként működik, társítva ezt a hatást a béta-hidroxi-butirát sav jelenlétével. Számos tanulmány kimutatta, hogy hosszú távú alkalmazása nem okoz súlynövekedési rendellenességeket 16,19. Esetünkben a ketogén étrend lipidek és fehérjék, valamint szénhidrátok aránya 3: 1, életkor és súly szerint alkalmazkodik a táplálkozási igényekhez, hangsúlyozva a vitaminok és ásványi anyagok szükségleteinek kielégítését. Közel 6 éves követés után a páciens normális növekedéssel rendelkezik, súlyát és magasságát megfigyeli a 75 százalékban, CML 15,8 kg/m 2, az életkorának megfelelő tartományban.
Valamennyi leírt esetnek van némi kognitív károsodása, amely a tanulási zavaroktól a súlyos mentális retardációig terjed. Ezenkívül a dysarthriát leíró nyelvi változásokat is megfigyeltek, az expresszív és a befogadó nyelv megváltoztatásával 1 5. Esetünk normális kognitív fejlődéssel rendelkezik, teljes IQ-ja 103 és verbális IQ-értéke 119, ez utóbbit a magas normál tartományba sorolják, amelyek amely eltér az irodalomban találhatóaktól. Ennek két oka lehet: egyikük a diagnózis kora, mivel az ismertetett betegek többségét későn észlelték. A másik, hogy a hiányzás vagy a deléció típusú mutációk egy része mérsékelt klinikai formával társult. A javasolt genotípus/fenotípus korreláció olyan hipotézis, amely nagyobb esetek megerősítését igényli. Továbbá az esetünkben talált mutációt egy másik családban sem írták le 3,20 .
HIVATKOZÁSOK
1. De Vivo D, Trifiletti R, Jacobson R, Roñen G, Behmand R, Heik S. Hiányos glükóztranszport a vér-agy bameren keresztül, mint tartós hypoglycorrhachia, görcsrohamok és fejlődési késedelem oka. N Engl J Med. 1991; 325: 703-9. [Linkek]
2. Wang D, Brockmann K, Korenke CG, Von Moers A, Ho YY, Pascual JM et al. Glut-1-hiány szindróma: az R126H missense mutáció autoszomális domináns átvitele. Ann Neurol. 2001; 50: S124. [Linkek]
3. Wang D, Pascual J, Yang H, Engelstad K, Jhung S, Peng Sun R, De Vivo D. Glut-1 hiány szindróma: klinikai, genetikai és terápiás szempontok. Ann Neurol. 2005; 57: 111-18. [Linkek]
4. Von Moers A, Brockmann K, Wang D, Korenke CG, Huppke P, De Vivo DC, Hanefeld F. A glut-1 hiány szindróma EEG jellemzői. Epilepszia. 2002; 43: 941-5. [Linkek]
5. Pascual J, Wang D, Lecumberri B, Yang H, Mao X, Yang R, De Vivo D. GLUT1 hiány és egyéb glükóz transzporter betegségek. Eur J Endocrinol. 2004; 150: 627-33. [Linkek]
6. Pascual J, Van Heerttum R, Wang D, Engelstad K, De Vivo D. A Glutl-hiány metabolikus lábnyomának leképezése az agyon. Ann Neurol. 2002; 52: 458-64. [Linkek]
7. Acosta P. Glükóz transzport fehérje hiba, piru-vate dehidrogenáz komplex hiány és kezelhetetlen rohamok. In: Acosta P, Yannicelli S. szerk. Táplálkozástámogató protokollok: Editorial Abbott Laboratories, 2001; 279-95. [Linkek]
8. Klepper J, Diefenbach S, Kohlschütter A, Voit T. A ketogén étrend hatása a glükóz transzporter 1 hiány szindrómában. Prostaglan-dins Leukot esszenciális zsírsavak. 2004; 70: 321-7. [Linkek]
9. Dogwood V. A ketogén étrend a refrakter epilepszia kezelésében. Rev ChilNutr. 2000; 27, 326-31. [Linkek]
10. Dogwood V. Ketogén diéta a gyermekgyógyászatban. In: Sanjurjo P, Baldellou A, szerk. Örökletes anyagcsere-betegségek diagnosztizálása és kezelése: Editorial Ergon SA, Madrid, Spanyolország, 2001; 111-120. [Linkek]
11. Klepper J, Garcia Alvarez M, O'Driscoll K, Parides M, Wang D, Yuan HO Y, De Vivo DC. Eritrocita 3-0. metil-D glükóz felvételi vizsgálat a glükóz-transzport-fehérje szindróma diagnosztizálására. J Clin Lab Anal. 1999; 13: 116-21. [Linkek]
12. Wechsler D. Kézikönyv a Wechsler intelligencia skálához a gyermekek számára - átdolgozott. San Antonio Texas: Szerkesztőség: The Psychological Corporation, Harcourt Brace Jovanovich, Inc. 1974. [Linkek]
13. Kuczmarski R, Ogden C, Grummer-Strawn L. CDC növekedési diagramok: Egyesült Államok. Fejlett adatok a létfontosságú és az egészségügyi statisztikákból;No. 314. Hyattsville, Maryland: Nemzeti Egészségügyi Statisztikai Központ 2000. szerkesztősége. [Linkek]
14. Villalobos N, Vergara A, Jara C, Orellana N, Maggi A, Torres M, González I. A hiány és a túlzások miatti alultápláltság ambuláns kezelése 6 év alatti gyermekeknél. Egészségügyi Minisztérium, Chile kormánya, 2005: 7–14. [Linkek]
15. Gordon N, Newton R. 1. típusú glükóztranszporter (GLUT-1) hiány. Brain Dev. 2003; 27: 477-80. [Linkek]
16. Bailey E, Pfeifer H, Thiele E. Az étrend alkalmazása az epilepszia kezelésében. Epilepszia és viselkedés. 2005; 6: 4-8. [Linkek]
17. Vamecq J, Vallée L, Lesage F, Gressens P, Stables J. Antiepileptikus népszerű ketogén étrend: feltörekvő fordulatok egy ősi történetben. Neurobiol Prog. 2005; 75: 1-28. [Linkek]
18. Couch S, Schwarzman F, Carroll J, Koenigsberger D, Nordli D, Deckelbaum R et al. A ketogén étrenddel kezelt gyermekek növekedési és táplálkozási eredményei. J Am Diet Assoc. 1999; 99: 1573-5. [Linkek]
19. Liu Y, Williams S, Basualdo-Hammond C, Stephens D, Curtis R. Prospektív tanulmány: ketogén diétával kezelt gyermekek növekedése és tápláltsági állapota. J Am Diet Assoc. 2003; 103: 707-12. [Linkek]
20. Wang D, Kranz-Eble P, De Vivo DC. A GLUT1 (SLC2A1) mutációs elemzése Glut-1 hiány szindrómában. Hum mutat. 2000; 16: 224-31. [Linkek]
Köszönöm
A Bostoni Gyermekkórházhoz, különösen Dr. Darryl De Vivo-hoz, aki elvégezte az eset molekuláris vizsgálatát.
2005. május 9-én kapott - 2006. augusztus 28-án fogadta el.
Levelezés: Prof. Verónica Cornejo E. INTA, Chilei Egyetem. Box 13811, Santiago, Chile. Fax: 56-2-2941254. E-mail: [email protected]
A magazin teljes tartalma, kivéve, ha azonosítják, a Creative Commons Licenc alatt van
Bernarda Morín 488, Providencia,
168. doboz, 55. levél
Santiago, Chile
Tel .: (56-2) 2753 5520
- Minden harmadik elhízott spanyol kipróbált valamiféle csoda diétát
- V A VI #JornadasDSP ketogén étrend, barát vagy ellenség bemutatása
- Keto metélõhagymás puding - Ketotrace ketogén étrend
- Milyen ételeket kerülni kell a ketogén étrenden Keto diéta
- Mit kell enni a vércsoportos étrend szerint; Tannos; Chavez
