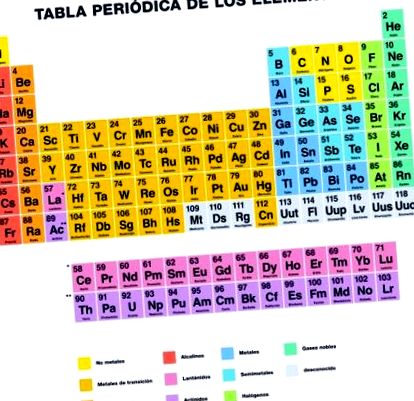
Mi az elemek periódusos táblázata?
A periódusos rendszer, vagy az elemek periódusos táblázata a a kémiai elemek szervezett nyilvántartása atomszámának, tulajdonságainak és jellemzőinek megfelelően.
118 elemből áll, amelyeket a Tiszta és Alkalmazott Kémia Nemzetközi Uniója (IUPAC, angol rövidítéssel) megerősített.
- A 94 a természetben létező elemek, és
- 24 elem szintetikus, vagyis mesterségesen jött létre.
Fejlesztése szorosan kapcsolódik az új elemek felfedezéséhez és közös tulajdonságaik tanulmányozásához. Olyan szempontok, mint az atomtömeg fogalma, valamint az atomtömeg és az elemek periódusos tulajdonságai közötti kapcsolatok, alapvető fontosságúak voltak a modern periódusos rendszer konfigurálásához.
A periódusos rendszer a kémia tanulmányozásának alapvető eszköze, mivel koherens és egyszerű módon lehetővé teszi a kémiai elemek közötti különbségek és hasonlóságok azonosítását.
Megalkotását Dimitri Mendelejev orosz tudósnak tulajdonítják 1869-ben. Azóta a periodikus táblázatot más tudósok fejlesztették és frissítették, mivel új elemeket fedeztek fel és tanulmányoztak.
Hogyan szerveződik a periódusos rendszer?
A periódusos rendszer az összes eddig ismert elemet bemutatja, amelyek jellemzőik és kapcsolatuk szerint vannak csoportosítva és elhelyezkedve csoportokban, periódusokban, blokkok és fémek, metalloidok és nemfémek.
Csoportok
A periódusos rendszer 18 elemcsoportból áll, függőleges oszlopokba rendezve, 1-től 18-ig számozva balról jobbra, kezdve az alkálifémektől és a nemesgázokig.
Az ugyanabba az oszlopba tartozó elemek hasonló kémiai jellemzőkkel rendelkeznek, annak alapján, hogy az elektronok miként épülnek fel az atom utolsó rétegében.
Például az első oszlop azokat az elemeket tartalmazza, amelyek az atom utolsó héjában elektront tartalmaznak. Ebben az esetben a káliumnak négy héja van, az utolsóban pedig egy elektronja.
A kémiai elemek az alábbiak szerint csoportosulnak:
- 1. csoport (I A): alkálifémek.
- 2. csoport (II A): alkáliföldfémek.
- 3. csoport (III B): skandiumcsalád.
- 4. csoport (IV B): titán család.
- 5. csoport (V B): vanádium család.
- 6. csoport (VI B): krómcsalád.
- 7. (VII B) csoport: mangán család.
- 8. csoport (VIII B): vascsalád.
- 9. csoport (VIII B): kobalt család.
- 10. csoport (VIII B): nikkelcsalád.
- 11. csoport (I B): rézcsalád.
- 12. csoport (II B): cink család.
- 13. (III A) csoport: földes.
- 14. (IV A) csoport: karbidok.
- 15. csoport (V A): nitrogenoidok.
- 16. (VI A) csoport: kalkogének vagy amfigének.
- 17. (VII A) csoport: halogének.
- 18. csoport (VIII A): nemesgázok.
Időszakok
A periódusok a periódusos rendszer hét vízszintes sora. Ezekben a sorokban csoportosítják azokat az elemeket, amelyeknek az elektronhéjainak száma egybeesik a periódus számával.
Például az első sorban a hidrogénnek és a héliumnak van elektronhéja. A második időszakban nyolc elem van, amelyeknek két elektronhéja van. A harmadik sorban az elemeknek három elektronhéja van, és így tovább.
A hatos időszakban azok az elemek vannak, amelyeknek hat elektronhéja van, mint például a lantanidok alsó sora. A hét periódusban azok az elemek vannak, amelyeknek hét elektronhéja van, valamint az aktinidok utolsó sora.
Fémek, metalloidok és nemfémek
A periódusos rendszert alkotó elemek három kategóriája különböztethető meg kémiai és fizikai tulajdonságaiktól: fémek, metalloidok és nemfémek.
- Fémek: szilárd elemek szobahőmérsékleten, levonva a folyékony halmazállapotú higanyt. Hajlékonyak és alakíthatók, jó hő- és villamosenergia-vezetők. Az asztal bal oldalán találhatók.
- Fémek nélkül: Leginkább gázok, bár vannak folyadékok is. Ezek az elemek nem jó elektromos vezetők. Az asztal jobb oldalán találhatók.
- Metalloidok vagy félfémek: fémek és nemfémek tulajdonságai is vannak. Lehet fényes, átlátszatlan és nem túl rugalmas. Elektromos vezetőképessége alacsonyabb, mint a fémeké, de magasabb, mint a nemfémeké. Az asztal jobb oldalán találhatók, fémek és nemfémek között.
Blokkok
A periódusos rendszer szintén négy blokkra osztható az egyes elemek elektronhéjainak sorrendje alapján. Minden blokk neve annak a pályának megfelelően származik, amelyben az utolsó elektron található.
- S blokk: alkálifémek, alkáliföldfémek, hidrogén és hélium 1. és 2. csoportja.
- P blokk: a 13-18 csoportokat és a metalloidokat fedi le.
- D blokk: 3–12 csoportból és átmenetifémekből áll.
- F blokk: nincs csoportszáma, és megfelel a lantanidoknak és az aktinideknek. Általában a periódusos rendszer alatt helyezkednek el.
Periódusos rendszer trendjei
Az időszakos trendek azokra a fő fizikai és kémiai tulajdonságokra utalnak, amelyek az elemekkel rendelkeznek, és amelyek lehetővé teszik rendszerezésüket a periódusos rendszerben. Ezek a tendenciák kapcsolódnak az egyes elemek atomszerkezetében bekövetkező változásokhoz annak az időszaknak vagy csoportnak megfelelően, amelyhez tartozik.
Az időszakos tendenciák a következők:
A kémiai elemek alapadatai
A periódusos táblázatok általában tartalmazzák az egyes meglévő elemek alapvető adatait, amelyek lehetővé teszik a jellemzők, például a szimbólum, a név, az atomszám és az atomtömeg alapján egy koherens szervezet létrehozását annak használatának meghatározásához.
- Atomtömeg: az atom protonokból és neutronokból álló tömegére utal.
- Ionizációs energia: az az energia, amely szükséges az elektron elválasztásához az atomtól.
- Kémiai szimbólum: rövidítések a kémiai elem azonosítására.
- Név: a kémiai elemnek adott név latinból, angolból, franciából, németből vagy oroszból származhat.
- Elektronikus konfiguráció: hogy az elektronok hogyan épülnek fel vagy szerveződnek egy atomban.
- Atomszám: egy atom protonjainak teljes számára utal.
- Elektronegativitás: az atom azon képessége, hogy vonzza az elektronokat önmagához.
- Oxidációs állapotok: az összetett kémiai elem részét képező atom oxidációs fokának mutatója.
Mire szolgál a periódusos rendszer?
A periódusos rendszer nagyon hasznos a természettudományi tanulmányokhoz, tekintettel a különböző funkciókra.
- Ez lehetővé teszi a különböző elemek közötti különbségek és hasonlóságok azonosítását. Például értékes információkat tartalmaz, például az egyes elemek atomtömegét.
- Lehetővé teszi az elemek kémiai viselkedésének elemzését. Például, amikor megkülönböztetjük az elem elektronegativitását és elektronikus konfigurációját.
- Alapvető eszköz a kémia, ezen belül a biológia és más tudományágak tanulmányozásában, mivel azonosítja a kémiai elemek főbb jellemzőit.
- Ez megkönnyíti az elemek megkülönböztetését atomszámuktól. Az elemek ugyanis atomokból tevődnek össze, amelyek megkapják a nevüket, és megkülönböztetik az abban lévő protonok, elektronok és neutronok számától.
- Fel lehet használni a táblázatba foglalandó új elemek kémiai tulajdonságainak előrejelzésére, figyelembe véve a már meghatározott elemek jellemzőit.
A periódusos rendszer története
A periódusos rendszer létrehozását Dmitri Mendelejev orosz tudósnak tulajdonítják, aki 1869-ben táblázatba gyűjtötte a tudomány által eddig ismert 63 elemet.
Mendelejev növekvő sorrendbe szervezte az elemeket az atomtömegük szerint, ügyelve arra, hogy ugyanabba az oszlopba helyezzék azokat, akiknek fizikai tulajdonságai hasonlóak. Még üres helyeket is hagyott, és számított arra, hogy léteznek még akkoriban még fel nem fedezett elemek, és ezt fel kell venni a táblázatba.
Nem sokkal ezután Julius Lothar Meyer német vegyész az atomok fizikai tulajdonságai alapján rendezte az elemeket. Végül jelenlegi struktúráját Alfred Werner svájci tudósnak köszönheti.
A periódusos rendszer utolsó jelentős változása a kémiai Nobel-díjas Glenn Seaborg munkája, aki többek között az aktinid-sorozatot a lantanid-sorozat alá rendelte.
- A távegészségügy Mi ez, hogyan kell felkészülni, a Nemzeti Öregedési Intézet ismerteti
- Hogyan lehet megtudni, hogy a kutyám ideális súlyú-e?
- A turmixod zsírossá tesz. Tudjuk, hogyan kerülhetjük el
- Surimi, miből áll, hogyan készül és mi járul hozzá a testhez?
- Milyen ásványi anyagokat veszít el az izzadság és hogyan helyettesítheti azokat a Supradyn®, vitamin komplex