2.1: Korai elképzelések az atomelméletben
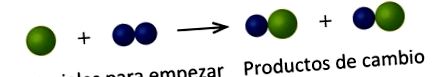
A következő rajzon a zöld gömbök egy bizonyos elem atomjait képviselik. A kék gömbök egy másik elem atomjait képviselik. Ha a különböző elemek gömbjei összeérnek, akkor a vegyület egyetlen egységének részei. Az e szférák által képviselt következő kémiai változás sértheti Dalton atomelméletének egyik gondolatát. Melyik?
A kiindulási anyagok egy zöld gömbből és két kék gömbből állnak. A termékek két zöld gömbből és két kék gömbből állnak. Ez sérti Dalton azon feltételezését, miszerint az atomok nem egy kémiai változás során jönnek létre, hanem egyszerűen újra eloszlanak.
Dalton elméletének melyik posztulátuma felel meg a reagensek és a termékek tömegére vonatkozó alábbi megfigyelésnek? 100 gramm szilárd kalcium-karbonát melegítésével 44 gramm szén-dioxid és 56 gramm kalcium-oxid keletkezik.
Határozza meg Dalton elméletének azt a posztulátumát, amelyet az alábbi megfigyelések megsértenek: a titán-dioxid-minta 59,95% -a titán; A titán-dioxid különböző mintáinak 60,10% -a titán.
Ez a megállapítás sérti Dalton negyedik posztulátumát: egy adott vegyületben az egyes típusok atomszámának (és ezáltal a százalékának is) mindig ugyanaz az aránya.
Az X, Y és Z vegyület mintákat elemezzük, az eredményeket itt mutatjuk be.
| x | Tiszta folyadék, színtelen, erős szagú. | 1,776 g | 0,148 g |
| Y | Tiszta folyadék, színtelen, erős szagú. | 1,974 g | 0,329 g |
| Z | Tiszta folyadék, színtelen, erős szagú. | 7,812 g | 0,651 g |
Ezek az adatok mutatnak-e példákat a meghatározott arányok törvényére, a többszörös arány törvényére, egyik vagy mindkét törvényre? Mit mondanak ezek a tények az X, Y és Z vegyületekről?
2.2: Az atomelmélet alakulása
Kiképzés
- Az izotópok létezése megsérti Dalton atomelméletének egyik eredeti elképzelését. Melyik?
- Milyenek az elektronok és a protonok? Mi a különbség köztük?
- Milyenek a protonok és a neutronok? Mi a különbség köztük?
- Tippelje meg és tesztelje a "szilva puding" modellatommal szemben kilőtt α részecskék viselkedését.
- Megjósolja azokat az α részecskék útjait, amelyek a Thomson szilva puding modell felépítésével az atomokra lőnek. Magyarázza el, miért várja az α részecskéket ezen az úton.
- Ha az a) pontban leírtaknál nagyobb energiájú α részecskéket a szilva puding atomokra lőnek, akkor jósolják meg, hogy pályájuk hogyan különbözik az alacsonyabb energiájú α részecskék pályáitól. Magyarázza el az érvelését.
- Most tesztelje az (a) és (b) előrejelzéseit. Nyissa meg a Rutherford szórásszimuláció és válassza a "Plum Pudding Atom" fület. Állítsa az "Alfa részecske energia" értéket "min" értékre, és válassza a "nyomok megjelenítése" lehetőséget. Kattintson a fegyverre az α részecskék lövöldözésének megkezdéséhez. Ez megegyezik az (a) alapján tett jóslatával? Ha nem, magyarázza el, miért lenne az a tényleges útvonal, amelyet a szimuláció mutat. Nyomja meg a szünet gombot, vagy az "Összes visszaállítása" gombot. Állítsa az "Alfa részecske energiát" "max" értékre, és kezdje el α részecskék felvételét. Megfelel-e ez a (b) pontról? Ha nem, magyarázza el az energia növekedésének a valós útvonalakra gyakorolt hatását a szimulációban bemutatott módon.
- Tippelje meg és tesztelje a kilőtt α részecskék viselkedését Rutherford atom modellben.
- (a) Megjósolni az α részecskék által megtett utakat, amelyek a Rutherford atommodell szerkezetű atomokra lőnek. Magyarázza el, miért várja az α részecskéket ezen az úton.
- (b) Ha az a) pontban leírtaknál nagyobb energiájú α részecskéket lőnek ki a Rutherford atomokra, akkor jósolják meg, miben különböznek a pályájuk az alacsonyabb energiájú α részecskék pályáitól. Magyarázza el az érvelését.
- (c) Tippelje meg, hogy az α részecskék milyen utakon haladnak, ha az aranytól eltérő elemek Rutherford-atomjaira lőnek. Remélhetőleg mely tényező okozza ezt a különbséget az utakon és miért?
- (d) Most tesztelje az (a), (b) és (c) előrejelzéseit. Nyissa meg a Rutherford szórásszimuláció és válassza a "Rutherford Atom" fület. A szimuláció nagysága miatt a legjobb, ha egy kis maggal kezdjük, ezért a protonok és a neutronok közül válassza a "20" -t, az energia számára a "min" értéket, mutassa meg a nyomokat, majd kezdje el α részecskék lövését. Ez megegyezik az (a) alapján tett jóslatával? Ha nem, magyarázza el, miért lenne a szimulációban bemutatott tényleges útvonal. Szüneteltesse vagy indítsa újra, állítsa az energiát "max" értékre, és kezdje el az α részecskék felvételét. Megfelel-e ez a (b) pontról? Ha nem, magyarázza el az energia növekedésének a valós útra gyakorolt hatását a szimulációban bemutatott módon. Szüneteltetés vagy újrakezdés, válassza a "40" -et protonok és neutronok esetén, a "min" -t az energiáért, mutassa meg a nyomokat és lőjön. Ez megegyezik a (c) alapján tett jóslatával? Ha nem, magyarázza el, miért lenne az a tényleges útvonal, amelyet a szimuláció mutat. Ismételje meg ezt nagyobb számú protonnal és neutronnal. Milyen általánosítást tehet az atom típusáról és az α részecskék útjára gyakorolt hatásról? Legyen egyértelmű és konkrét a válaszában.
Megoldások
1 Dalton eredetileg úgy gondolta, hogy egy adott elem összes atomjának azonos tulajdonságai vannak, beleértve a tömeget is. Ezért az izotópok fogalma, amelyben egy elemnek más a tömege, megsértette az eredeti elképzelést. Az izotópok létezésének magyarázata érdekében az atomelmélet második posztulátumát módosították annak megállapítására, hogy ugyanazon elem atomjainak azonos kémiai tulajdonságokkal kell rendelkezniük.
2 Mindkettő szubatomi részecske, amelyek az atommagban helyezkednek el. Mindkettőjük nagyjából azonos tömegű. A protonok pozitív töltésűek, míg a neutronok töltetlenek.
3 Mindkettő szubatomi részecske, amelyek az atommagban helyezkednek el. Mindkettőjük nagyjából azonos tömegű. A protonok pozitív töltésűek, míg a neutronok töltetlenek.
4. a) A szilva puding modell azt jelzi, hogy a pozitív töltés egyenletesen oszlik el az atomban, ezért arra számítunk, hogy az α részecskéket (esetleg) a pozitív-pozitív taszítás kissé csökkenti, de egyenes vonalban haladnak (vagyis nem szabad eltéríteni), amikor áthaladnak az atomokon. (b) A magasabb energiájú α részecskék gyorsabban haladnak (és talán lelassulnak), és egyenes vonalú utakat is követnek az atomokon keresztül. (c) Az α részecskék egyenes vonalat követtek a szilva puding atomján. Nem volt látható csökkenés az α-részecskékben, amikor áthaladtak az atomokon.
5. a) A Rutherford atomnak van egy kicsi, pozitív töltésű magja, így a legtöbb α részecske áthalad az üres téren a magtól, és nem térül el. A mag közelében áthaladó α-részecskék a pozitív-pozitív taszítás következtében eltérnek útjaiktól. Minél közvetlenül a mag felé irányítják az α részecskéket, annál nagyobb az elhajlás szöge. (b) A nagyobb energiájú α részecskék, amelyek közel kerülnek a maghoz, továbbra is elhajlanak, de minél gyorsabban haladnak, az elhajlási szög a vártnál kisebb lesz. (c) Ha a mag kisebb, akkor a pozitív töltés kisebb és a várható elhajlások kisebbek, mind azt tekintve, hogy az α-részecskék milyen mélyen haladnak át a magon az elhajlás nélkül, és az elhajlás szöge szempontjából. Ha a mag nagyobb, akkor a pozitív töltés nagyobb, és a várható elhajlások nagyobbak: több α részecske hajlik el, és az elhajlási szögek nagyobbak lesznek. (d) Az α részecskék által követett útvonalak egybeesnek az (a), (b) és (c) előrejelzéseivel.
2.3: Atomszerkezet és szimbolika
Milyen módon különböznek mindig egy adott elem izotópjai? Milyen módon (ek) mindig ugyanazok?
Írja be a szimbólumot a következő ionok mindegyikéhez:
- a) az 1+ töltésű ion, az 55-ös atomszám és a 133-as tömegszám
- (b) az ion 54 elektronnal, 53 protonnal és 74 neutronnal
- c) a 15-ös atomszámú, 31-es tömegű és 3-os töltésű ion
- d) az ion 24 elektron, 30 neutron és 3 töltésű+
a) 133 Cs +; b) 127 I -; (c) 31P3; d) 57 Co 3+
Írja be a szimbólumot a következő ionok mindegyikéhez:
- a) 3+ töltésű, 28 elektronos és 71 tömegszámú ion
- (b) az ion 36 elektronnal, 35 protonnal és 45 neutronnal
- (c) az ion 86 elektronnal, 142 neutronnal és 4 töltéssel+
- d) a 2+ töltésű, 38-as atomszámú és 87-es tömegű ion
Nyissa meg a szimuláció felépítését, majd kattintson az atom ikonra.
- (a) Válassza ki az első 10 elem bármelyikét, amelyet fel szeretne építeni, és jelölje meg annak szimbólumát.
- (b) Húzza a protonokat, a neutronokat és az elektronokat az atom sablonjára, hogy alkotó atomot alkosson. Adja meg az atomjában lévő protonok, neutronok és elektronok számát, adja meg a nettó töltést és a tömegszámot is.
- (c) Kattintson a "Nettó terhelés" és a "Tömegszám" gombra, ellenőrizze a (b) pontban megadott válaszait, és ha szükséges, helyesbítse.
- (d) Tippelje meg, hogy atomja stabil vagy instabil lesz-e. Kérjük, fejtse ki érvelését.
- (e) Jelölje be a "Stabil/instabil" négyzetet. Helyes volt-e a (d) kérdésre adott válasz? Ha nem, akkor először megjósolja, mit tehet annak érdekében, hogy stabil atomot alkosson az eleméből, majd nézze meg, hogy működik-e. Magyarázza el az érvelését.
a) szén-12, 12 C; (b) Ez az atom hat protont és hat neutront tartalmaz. A semleges 12 C atomban hat elektron van, ennek a semleges atomnak a nettó töltése nulla, a tömegszáma pedig 12. (c) A fenti válaszok helyesek. (d) Az atom stabil lesz, mivel a C-12 a szén stabil izotópja. (e) Az előző válasz helyes. Erre a gyakorlatra más válaszok is lehetségesek, ha az izotópotól eltérő elemet választanak.
(a) Húzza a protonokat, a neutronokat és az elektronokat az atom sablonra egy semleges oxigén-16 atom létrehozásához és az atom izotópos szimbólumának megadásához.
(b) Most adj hozzá még két elektronot egy ion kialakításához, és add meg az általad készített ion szimbólumát.
(a) Húzza a protonokat, a neutronokat és az elektronokat az atom sablonra, így semleges lítium-6 atomot kap, és megadja ennek az atomnak az izotóp szimbólumát.
(b) Most távolítson el egy elektronból egy iont, és adja meg az elkészített ion szimbólumát.
(a) A lítium-6 három protont, három neutront és három elektronot tartalmaz. Az izotóp szimbóluma 6 Li vagy \ (\ ce<^6_3Li>\). b) 6 Li + o \ (\ ce<^6_3Li+>\)
Határozza meg a protonok, a neutronok és az elektronok számát az alábbi orvosi diagnózisokban használt izotópokban:
a) 9-es atomszám, 18-as tömeg, 1−1 töltés
b) 43-os atomszám, 99-es tömegszám, 7-es töltés+
(c) 53-os atomszám, 131-es atomtömeg, 1−2 töltés
d) 81. atomszám, 201 atomtömeg, 1 töltés+
e) Nevezze meg az elemeket az a), b), c) és d) részben.
Az alábbiakban két elem izotópjainak tulajdonságait tekinthetjük meg, amelyek elengedhetetlenek az étrendünkben. Határozza meg a protonok, neutronok és elektronok számát mindegyikben, és nevezze meg őket.
a) 26-os atomszám, 58-as tömeg, 2-es töltés+
(b) 53-as atomszám, 127. tömegszám, 1−2 töltés
a) vas, 26 proton, 24 elektron és 32 neutron; (b) jód, 53 proton, 54 elektron és 74 neutron
Adja meg a protonok, elektronok és neutronok számát a következő izotópok semleges atomjaiban:
Adja meg a protonok, elektronok és neutronok számát a következő izotópok semleges atomjaiban:
(a) 3 proton, 3 elektron, 4 neutron; (b) 52 proton, 52 elektron, 73 neutron; (c) 47 proton, 47 elektron, 62 neutron; (d) 7 proton, 7 elektron, 8 neutron; (e) 15 proton, 15 elektron, 16 neutron
Kattintson a webhely és válassza ki az "izotópok keveréke" fület, rejtse el a "százalékos összetétel" és az "átlagos atomtömeg" négyzeteket, majd válassza ki a bór elemet.
(a) Írja le a bór izotópjainak szimbólumait, amelyek jelentős mennyiségben természetesek.
(b) Becsülje meg ezeknek a bór-izotópoknak a természetben előforduló relatív mennyiségét (százalékos arányát). Magyarázza el a választása mögött álló érvelést.
(c) Adjon izotópokat a fekete dobozhoz, hogy olyan keveréket készítsen, amely megfelel a (b) pontban szereplő jóslatának. Húzhatja az izotópokat a tálcájukról, vagy kattintson a "Tovább" gombra, majd mozgassa a csúszkákat a megfelelő mennyiségre.
(d) Nyissa meg a "Százalékos összetétel" és az "Átlagos atomtömeg" rovatokat. Mennyire felel meg jóslata a jóslatnak? Szükség esetén állítsa be az izotóp mennyiségét az előrejelzésének megfelelően.
(e) Válassza ki az izotópkeveréket a "Természet" pontból, és hasonlítsa össze az előrejelzésével. Mennyire hasonlít jóslata a természetes keverékhez? Magyarázza el. Ha szükséges, állítsa be az összegeket, hogy a lehető legpontosabban illeszkedjenek a "Természet" összegekhez.
Ismételje meg a gyakorlat három természetes izotóppal rendelkező elem felhasználásával.
Vegyük példaként a neont. A neonnak három izotópja van, és nem lehet biztos abban, hogy pontosan megjósoljuk a bőségeket, hogy összesen 20,18 amu átlagos atomtömeg legyen. Tegyük fel, hogy a bőség 9% Ne-22, 91% Ne-20, és csak a Ne-21 nyoma. Az átlagos tömeg 20,18 amu lenne. Az izotópok természetes keverékének ellenőrzése azt mutatja, hogy a bőség 90,48% Ne-20, 9,25% Ne-22 és 0,27% Ne-21, ezért becsült mennyiségeinket kissé módosítani kell.
Egy elemnek a következő természetes bősége és izotóptömege van: 90,92%, 19,99 amu, 0,26% 20,99, és 8,82%, 21,99 amu. Számítsa ki ennek az elemnek az átlagos atomi tömegét.
Az IUPAC által felsorolt átlagos atomtömegek a kísérleti eredmények tanulmányán alapulnak. A brómnak két 79 Br és 81 Br izotópja van, amelyek tömegét (78,9183 és 80,9163 amu) és mennyiségét (50,69% és 49,31%) az előző kísérletek során meghatározták. Ezen kísérletek alapján számítsa ki a bróm átlagos atomtömegét.
Különböző forrásokból származó elemeknél megfigyelhető az átlagos atomi tömeg változása. A lítium erre példa. A természetes ásványokból származó lítium izotópos összetétele 7,5% 6 Li és 92,5% 7 Li, amelyek tömege 6,01512 amu és 7,01600 amu. Katonai forrásból újrahasznosított kereskedelmi lítiumforrás 3,75% 6 Li (és a maradék 7 Li) volt. Számítsa ki a két forrás átlagos atomtömeg-értékét.
Egyes elemek átlagos atomtömege változhat, az ásványi anyagok forrásaitól függően. A természetes bór két, pontosan ismert tömegű izotópból áll (10 B, 10.0129 amu és 11 B, 11.0931 amu). A bór tényleges atomtömege 10 807 és 10 819 között változhat, attól függően, hogy az ásványi forrás Törökországból vagy az Egyesült Államokból származik-e. Számítsa ki a bór átlagos atomtömegének két értékéhez vezető százalékos bőséget e két ország esetében.
Törökországi forrás: 0,2649 (10 0129 amu izotópból); Amerikai forrás: 0,2537 (10 0129 amu izotópból)
A 18 O: 16 O bőségarány egyes meteoritokban magasabb, mint a földi oxigén átlagos atomtömegének kiszámításához használt érték. Az oxigénatom átlagos tömege ezekben a meteoritokban nagyobb, kisebb vagy egyenlő-e a földi oxigénatom tömegével?
2.4: Kémiai képletek
Magyarázza el, miért különbözik az oxigénelem atomjának szimbóluma és az oxigénmolekula képlete.
Az oxigén elem szimbóluma, O, mind az elemet, mind az oxigénatomot jelöli. Az oxigénmolekula, az O2, két oxigénatomot tartalmaz; A képletben szereplő 2 indexet arra kell használni, hogy meg lehessen különböztetni a diatóma molekulát két egyedi oxigénatomtól.
Magyarázza el, miért különbözik a kén elem szimbóluma és egy kénmolekula képlete.
Írja meg a következő vegyületek molekuláris és empirikus képleteit:
- Milyen gyakorlatokat kell csinálni, ha túlsúlyos vagyok
- Milyen gyakorlatokat kell tenni a has csökkentésére 2018-ban 🏆
- Milyen gyakorlatokat tehetek a lábam karcsúsítására otthon
- Milyen gyümölcssalátákat fogyasszon edzés előtt vagy után Táplálkozási gyakorlatok Fitness étrend
- Milyen gyakorlatokat, oszlopokat és egyéb fizikai tevékenységeket végez, milyen gyakran? Milyen típusú